你可能感兴趣的试题
N2、O2的体积比约为5:1 N2、O2等气体均匀混合 N2、O2不再保持各自的化学性质 空气由空气分子构成
空气由空气分子构成 N2、O2等均匀混合 N2、O2不再保持各自的化学性质 N2、O2的体积比约为5:1
18O仅存在于O2中 18O不可能存在于N2O中 18O可存在于以上各物质中 18O仅可能存在于N2O3,N2O5中
NH4Cl中的N.元素被还原 生成1 mol N2时转移的电子数为6 mol NaNO2 是氧化剂 N2既是氧化剂又是还原剂
32 g O2占的体积约为22.4 L 22.4L. N2 含阿伏加德罗常数个 N2 分子 在标准状况下,22.4L. H2O 的质量约为 18 g 22gCO2与标准状况下11.2L. HCl,含有相同分子数
空气由空气分子构成 N2、O2等均匀混合 N2、O2不再保持各自的化学性质 N2、O2的体积比约为5∶1
分子中N.、O.间形成的共价键是非极性键 分子中四个氮原子共平面 该物质既有氧化性又有还原性 15.2g该物质含有6.02×1022个原子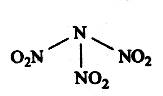
为阿伏伽德罗常数的值,下列说法正确的是( ) A.1mol二甲醚中含有的C.—O键的数目为2N.A 标准状况下,44.8L HF中含有分子的数目为2N.A 200g质量分数为23%的HCOOH水溶液中含氧原子的总数目为2N.A 在反应Cu2S+O2 2Cu+SO2中,每生成1molCu,转移电子的数目为2N.A
2Cu+SO2中,每生成1molCu,转移电子的数目为2N.A
空气由空气分子构成 N2、O2等均匀地混合 N2、O2不再保持各自的化学性质 N2、O2的体积比约为5:1
表示阿伏加德罗常数的值,下列说法中正确的是 ( ) A.1 mol H3O+ 所含质子数为10N.A 40克氖气所含分子数约为6.02×1023 标准状况下,22 .4 L SO2所含的分子数为N.A. 常温常压下32 g O2所含原子数不是2N.A
反应中每生成l mol N2O,转移4mol电子 N2O只有氧化性,无还原性 N2O和CO2互为等电子体 NO2属于酸性氧化物
空气由空气分子构成 N2、O2 等均匀地混合 N2、O2 不再保持各自的化学性质 N2、O2 的体积比约5∶1
上述反应中每生成1mol N2O,消耗67.2LCO 等质量的N2O和CO2含有相等的电子数 N2O只有氧化性,无还原性 上述反应中若有3 mol的CO被还原,则转移6NA个电子
上述反应中,每消耗2mol NO2,就会生成22.4L N2O 等质量的N2O和CO2含有相等的电子数 N2O有氧化性,且为HNO2的酸酐 N2O的氧化性强于NO2
N2O的空间构型与CO2构型不同 N2O的空间构型与H2O构型相似 N2O的空间构型与NH3构型相似 N2O的空间构型为直线形
上述反应,每生成lmolN2O,消耗67.2LCO 等物质的量的NO和CO含有相等的电子数 N2O只有氧化性,无还原性 CO会迅速与人体血红蛋白结合,使人中毒
该反应ΔS.<0 ΔH.>0 该反应ΔS.>0 ΔH.<0 该反应在低温下可以自发进行 该反应在加热时能自发进行的原因是ΔS.>0 ΔH.>0
标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA 常温下,22gCO2和N2O混合气体中,含有的原子数目为1.5NA 标准状况下,2.24L水中含有O—H键的数目为0.2NA 1molNa被完全氧化生成Na2O2,失去2NA电子
溶液的颜色从灰绿色变为橙色 Cr2O7n-发生氧化反应 若配平后Cr3+和CO2的化学计量数比为2:1,则Cr2O7n-中的n=2 若有3.2 g CH3OH参加反应,则转移的电子数为6.02×1022


 2Cu+SO2中,每生成1molCu,转移电子的数目为2N.A
2Cu+SO2中,每生成1molCu,转移电子的数目为2N.A