你可能感兴趣的试题
第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+杂质,加入的药品顺序为: Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 工业上金属钠是通过氯碱工业进行制取 从第③步到第⑤步的目的是为了浓缩 在第③④⑤步中溴元素均被氧化
大量的氮、磷废水排入海洋,易引发赤潮 流程②中结晶出的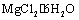 可在空气中受热分解制无水
可在空气中受热分解制无水 在流程③④⑤中溴元素均被氧化 流程①中除去粗盐中的
在流程③④⑤中溴元素均被氧化 流程①中除去粗盐中的 等杂质,加入的药品顺序为:
等杂质,加入的药品顺序为: 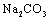 溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为: Na2CO3溶液―→NaOH溶液―→BaCl2溶液―→过滤后加盐酸 工业上金属钠是通过氯碱工业制取 从第③步到第⑤步的目的是为了富集溴元素。 在第③④⑤步中溴元素均被氧化
①粗盐提纯中除去杂质离子Mg2+、Ca2+、SO42-时,必须先除SO42-后除Ca2+ 过程中②是将MgCl2·6H2O在空气中受热脱水得到无水MgCl2 在③、④、⑤中,溴元素均被氧化 可用澄清石灰水检验Na2CO3和NaHCO3
第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为: Na2CO3溶液―→NaOH溶液―→BaCl2溶液―→过滤后加盐酸 工业上金属钠是通过氯碱工业制取 从第③步到第⑤步的目的是为了富集溴元素。 在第③④⑤步中溴元素均被氧化
工业上通过电解熔融状态MgCl2制取金属镁 用澄清的石灰水可鉴别NaHCO3和Na2CO3 在第②、④步骤中,溴元素均被氧化 制取NaHCO3的反应是利用其溶解度小于NaCl
大量的氮、磷废水排入海洋,易引发赤潮 工段②中结晶出的MgCl2・ 6H2O可直接在空气中加热分解制无水MgCl2 在工段③④⑤中溴元素均被氧化 工段①中除去粗盐中的SO42-、Ca2+ 、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+杂质,加入的药品顺序为: Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 工业上金属钠是通过氯碱工业进行制取 从第③步到第⑤步的目的是为了浓缩 在第③④⑤步中溴元素均被氧化
制取NaHCO3的反应是利用其溶解度比较小 除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 在第③、④、⑤步骤中,溴元素均被氧化 工业上通过电解饱和MgCl2溶液制取金属镁
制取NaHCO3的反应是利用其溶解度小于NaCl 用澄清的石灰水可鉴别NaHCO3和Na2CO3 在第③、④、⑤步骤中,溴元素均被氧化 工业上通过电解饱和MgCl2溶液制取金属镁
制取NaHCO3的反应是利用其溶解度小于NaCl和NH4Cl。 ①粗盐提纯中除去杂质离子Mg2+、Ca2+、SO42-时,必须先除Ca2+后除SO42- 在工段③、④、⑤中,溴元素均被氧化。 工业上通过电解饱和MgCl2溶液制取金属镁。
大量的氮、磷废水排入海洋,易引发赤潮 工段②中结晶出的MgCl2· 6H2O可在空气中受热分解制无水MgCl2 在工段③④⑤中溴元素均被氧化 工段①中除去粗盐中的SO42-、Ca2+ 、Mg2+、Fe3+等杂质,加入的药品顺序为: Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
制取NaHCO3的反应是利用其溶解度比较小 除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 在第③、④、⑤步骤中,溴元素均被氧化 工业上通过电解饱和MgCl2溶液制取金属镁
用澄清的石灰水可鉴别NaHCO3和Na2CO3 工业生产上向母液中加石灰乳使Mg2+转化为Mg(OH)2沉淀 在第③、④、⑤步骤中,溴元素均被氧化 工业上通过电解饱和MgCl2溶液制取金属镁
第①步中除去粗盐中的SO42-错误!未找到引用源。、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 工业上金属钠是通过氯碱工业制取 从第③步到第⑤步的目的是为了浓缩 在第③④⑤步中溴元素均被氧化
制取NaHCO3的反应是利用其溶解度小于NaCl 用澄清的石灰水可鉴别NaHCO3和Na2CO3 在第③、④、⑤步骤中,溴元素均被氧化 工业上通过电解饱和MgCl2溶液制取金属镁 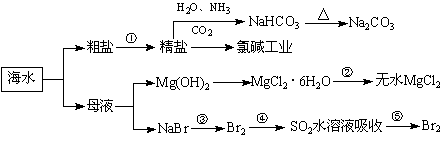

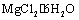 可在空气中受热分解制无水
可在空气中受热分解制无水 在流程③④⑤中溴元素均被氧化 流程①中除去粗盐中的
在流程③④⑤中溴元素均被氧化 流程①中除去粗盐中的 等杂质,加入的药品顺序为:
等杂质,加入的药品顺序为: 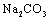 溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 
