你可能感兴趣的试题
⊿H1>⊿H2>⊿H3 ⊿H1<⊿H3<⊿H2 ⊿H1<⊿H2<⊿H3 ⊿H1>⊿H3>⊿H2
△H1>△H2>△H3 △H1<△H3<△H2 △H1=△H3>△H2 △H1>△H3>△H2
⊿H1>⊿H2>⊿H3 ⊿H1<⊿H3<⊿H2 ⊿Hl<⊿H2<⊿H3 ⊿H1>⊿H3>⊿H2
⊿H1>⊿H2>⊿H3 ⊿H1<⊿H3<⊿H2 ⊿H1<⊿H2<⊿H3 ⊿H1>⊿H3>⊿H2
中和热一定是强酸跟强碱反应放出的热量 1 mol酸与1 mol碱完全反应放出的热量是中和热 在稀溶液中,酸与碱发生中和反应生成1 mol H2O时的反应热叫做中和热 表示中和热的离子方程式为:H+(aq)+OH-(aq)=H2O(l); △H=57.3KJ/mol
ΔH 1>ΔH 3>ΔH 2 ΔH 1>ΔH 2>ΔH 3 ΔH 1<ΔH 3<ΔH 2 ΔH 1<ΔH 2<ΔH 3
⊿H1>⊿H2>⊿H3 ⊿H1<⊿H3<⊿H2 ⊿H1<⊿H2<⊿H3 ⊿H1>⊿H3>⊿H2
△H1>△H2>△H3 △H1<△H3<△H2 △H1<△H2<△H3 △H1>△H3>△H2
△H1>△H2>△H3 △H1<△H3<△H2 △H2>△H1>△H3 △H1>△H3>△H2
强酸跟强碱的反应热一定是中和热 1molC完全燃烧放热383.3kJ,其热化学方程为: +O2═CO2 △H=﹣383.3kJ•mol﹣1 C.在稀溶液中,强酸与强碱发生中和反应生成1molH.2O.时的反应热叫做中和热 表示中和热的离子方程式为:H.+(aq)+OH﹣(aq)═H.2O.(l);△H=57.3KJ•mol﹣1
ΔH1>ΔH2>ΔH3 ΔH1<ΔH2<ΔH3 ΔH1=ΔH2<ΔH3 ΔH1<ΔH2=ΔH3
⊿H1>⊿H2>⊿H3 ⊿H1<⊿H3<⊿H2 ⊿H1<⊿H2<⊿H3 ⊿H1>⊿H3>⊿H2
烧杯间填满金属碎末 大烧杯上不盖硬纸板 用相同浓度和体积的氨水代替NaOH溶液进行实验 用浓硫酸代替稀盐酸
⊿H1>⊿H2>⊿H3 ⊿H1<⊿H3<⊿H2 ⊿H1<⊿H2<⊿H3 ⊿H1>⊿H3>⊿H2
⊿H1>⊿H2>⊿H3 ⊿H1<⊿H3<⊿H2 ⊿Hl<⊿H2<⊿H3 ⊿H1>⊿H3>⊿H2
ΔH1>ΔH2>ΔH3 ΔH1<ΔH3<ΔH2 ΔH1=ΔH2=ΔH3 ΔH2<ΔH3<ΔH1
ΔH1>ΔH2>ΔH3 ΔH1<ΔH3<ΔH2 ΔH1<ΔH2<ΔH3 ΔH1>ΔH3>ΔH2
KOH(aq)+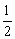 H2SO4(aq)
H2SO4(aq)
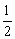 K2SO4(aq)+H2O(l) ΔH.=-57.3 kJ·mol-1 NaOH(aq)+HCl(aq)
K2SO4(aq)+H2O(l) ΔH.=-57.3 kJ·mol-1 NaOH(aq)+HCl(aq)  NaCl(aq)+H2O(l) ΔH.=+57.3 kJ·mol-1 H2SO4和Ca(OH)2反应的中和热为ΔH.=2×(-57.3) kJ·mol-1 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
NaCl(aq)+H2O(l) ΔH.=+57.3 kJ·mol-1 H2SO4和Ca(OH)2反应的中和热为ΔH.=2×(-57.3) kJ·mol-1 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
ΔH1=ΔH2=ΔH3 ΔH1>ΔH2>ΔH3 ΔH3>ΔH2>ΔH1 无法比较
⊿H1>⊿H2>⊿H3 ⊿H1<⊿H3<⊿H2 ⊿H1<⊿H2<⊿H3 ⊿H1>⊿H3>⊿H2

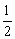 H2SO4(aq)
H2SO4(aq)
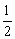 K2SO4(aq)+H2O(l) ΔH.=-57.3 kJ·mol-1 NaOH(aq)+HCl(aq)
K2SO4(aq)+H2O(l) ΔH.=-57.3 kJ·mol-1 NaOH(aq)+HCl(aq)  NaCl(aq)+H2O(l) ΔH.=+57.3 kJ·mol-1 H2SO4和Ca(OH)2反应的中和热为ΔH.=2×(-57.3) kJ·mol-1 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
NaCl(aq)+H2O(l) ΔH.=+57.3 kJ·mol-1 H2SO4和Ca(OH)2反应的中和热为ΔH.=2×(-57.3) kJ·mol-1 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量