你可能感兴趣的试题
pH = 0的NaHSO4溶液 0.04 mol·L-1 硫酸 0.5 mol·L-1 盐酸 0.05 mol·L-1硝酸
常温下,测得醋酸钠溶液的pH>7 常温下,测得0.1mol/L醋酸溶液的pH=4 常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4 常温下,将物质的量浓度相同的醋酸溶液与氢氧化钠溶液等体积混合后恰好中和
pH=6.5的溶液一定显酸性 0.1mol • L-1的Na2CO3溶液中:c(CO32-)+c(HCO3-)=0.1mol • L-1 常温下,等体积的0.2 mol • L-1的盐酸与0.2 mol • L-1的氢氧化钡溶液混合,所得溶液的pH=13 常温下,某溶液中水电离出的c(OH-)=l×10-12 mol • L-1,该溶液pH 一定等于2
0.1 mol·L-1 HR溶液的pH为5 HR为弱酸,常温时随着氨气的通入,  逐渐增大 当通入0.1 mol NH3时, c(NH4+)>c(R-)>c(OH-)>c(H+) 当c(R-)= c(HR)时,溶液必为中性
逐渐增大 当通入0.1 mol NH3时, c(NH4+)>c(R-)>c(OH-)>c(H+) 当c(R-)= c(HR)时,溶液必为中性
常温下,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 常温下,将pH =10的氨水稀释后,溶液中所有离子浓度都减小 常温下,0.1 mol/L Na2S溶液中存在:c(OH-) = c(H+) + c(HS-) + c(H2S) 常温下,pH为1的0.1 mol/L HA溶液与0.1 mol/L NaOH溶液恰好完全反应时,溶液中一定存在: c (Na+) = c(A-) > c(OH-) = c(H+)
c(H+):①>② 分别加入1L 0.1mol·L-1HCl溶液后,两溶液的pH:①<② 分别加入等浓度的盐酸至溶液呈中性,消耗盐酸的体积:①<② n(HF)+n(F)=n(HClO)+n(ClO)
在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF 若将CO2 通入0.1 mol·L-1Na2CO3溶液中至溶液中性,则溶液中 2 c (CO32ˉ)+ c (HCO3ˉ)= 0.1 mol·L-1 根据上表, 水解方程式ClOˉ+ H2O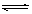 HClO + OHˉ的平衡常数K≈10ˉ7.6 向上述NaClO 溶液中通HF气体至恰好完全反应时:C.(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OHˉ)
HClO + OHˉ的平衡常数K≈10ˉ7.6 向上述NaClO 溶液中通HF气体至恰好完全反应时:C.(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OHˉ)
在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF 若将CO2 通入0.1 mol·L-1Na2CO3溶液中至溶液中性,则溶液中 2 c (CO32ˉ)+ c (HCO3ˉ)= 0.1 mol·L-1 根据上表, 水解方程式ClOˉ+ H2O HClO + OHˉ的平衡常数K≈10ˉ7.6 向上述NaClO 溶液中通HF气体至恰好完全反应时: c(Na+)>c(F.ˉ)>c(H+)>c(HClO)>c(OHˉ)
HClO + OHˉ的平衡常数K≈10ˉ7.6 向上述NaClO 溶液中通HF气体至恰好完全反应时: c(Na+)>c(F.ˉ)>c(H+)>c(HClO)>c(OHˉ)
7.0×10-7 mol·L-1 2.8×10-4 mol·L-1 5.6×10-4 mol·L-1 7.0×10-5 mol·L-1
常温下,pH等于14与pH等于12的两种NaOH溶液等体积混合后, c(H+)=(10-14+10-10)/2 常温下,浓度为1×10-10 mol·L.-1的KOH溶液的pH为7 氨水加水稀释,溶液中除水以外的所有粒子的浓度都减小 常温下,pH等于1的盐酸溶液中水的电离程度与pH等于13的Ba(OH)2溶液中水的电离程度相等
1∶10∶100∶1000 0∶1∶12∶11 14∶13∶12∶11 14∶13∶2∶3

 逐渐增大 当通入0.1 mol NH3时, c(NH4+)>c(R-)>c(OH-)>c(H+) 当c(R-)= c(HR)时,溶液必为中性
逐渐增大 当通入0.1 mol NH3时, c(NH4+)>c(R-)>c(OH-)>c(H+) 当c(R-)= c(HR)时,溶液必为中性
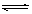 HClO + OHˉ的平衡常数K≈10ˉ7.6 向上述NaClO 溶液中通HF气体至恰好完全反应时:C.(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OHˉ)
HClO + OHˉ的平衡常数K≈10ˉ7.6 向上述NaClO 溶液中通HF气体至恰好完全反应时:C.(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OHˉ)
 HClO + OHˉ的平衡常数K≈10ˉ7.6 向上述NaClO 溶液中通HF气体至恰好完全反应时: c(Na+)>c(F.ˉ)>c(H+)>c(HClO)>c(OHˉ)
HClO + OHˉ的平衡常数K≈10ˉ7.6 向上述NaClO 溶液中通HF气体至恰好完全反应时: c(Na+)>c(F.ˉ)>c(H+)>c(HClO)>c(OHˉ)