
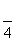 ) ( )y=2sin(2x+
) ( )y=2sin(2x+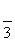 ) ( )y=2sin(2x–
) ( )y=2sin(2x–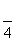 ) ( )y=2sin(2x–
) ( )y=2sin(2x–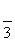 )
)
 ) y=2sin(2x+
) y=2sin(2x+ ) y=2sin(2x﹣
) y=2sin(2x﹣ ) y=2sin(2x﹣
) y=2sin(2x﹣ )
)
 ) y=2sin(2x﹣
) y=2sin(2x﹣ ) y=2sin(2x+
) y=2sin(2x+ ) y=2sin(2x﹣
) y=2sin(2x﹣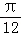 )
)
 ) f(x)= 2sin(3x+
) f(x)= 2sin(3x+ ) f(x)= 2sin(2x+
) f(x)= 2sin(2x+ ) f(x)= 2sin(2x一
) f(x)= 2sin(2x一 )
)