你可能感兴趣的试题
向蒸馏水中滴加浓H2SO4时,KW不变 常温下,0.005mol·L-1Ba(OH)2溶液pH为12 Na2CO3水解的离子方程式为:CO32- + 2H2O H2CO3 + 2OH- NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
H2CO3 + 2OH- NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
常温下,AgCl在饱和NaCl溶液中的Ksp比在纯水中的Ksp小 向AgCl的悬浊液中加入KI溶液,沉淀由白色转化为黄色 将0.001 mol•L﹣1的AgNO3溶液滴入KCl和KI的混合溶液中,一定先产生AgI沉淀 向AgCl的饱和溶液中加入NaCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl﹣)
常温下,AgCl在饱和NaCl溶液中的K.SP比在纯水中的K.SP小
向AgCl的悬浊液中加入KI溶液,沉淀由白色转化为黄色
将0.001 mol·L-1的AgNO3溶液滴入KCl和KI的混合溶液中,一定先产生AgI沉淀
向AgCl的饱和溶液中加入NaCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl-
c(Na+)>c(CO32-)>c(HCO3-)>c(H2CO3) c(Na+)>c(CO32-)>c(H+)>c(OH—) c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
氧化性(酸性溶液):FeCl3 > Co(OH)3 > I2 还原性(碱性溶液):Fe(OH)2 > I2 > KIO3 热稳定性:NaCl > NaClO4 > NaClO 酸性(水溶液):HSCN > H2CO3 > HCN
常温下pH=7的溶液中:Fe3+、Mg2+、SO 、Cl-能大量共存 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳: ClO-+CO2+ H2O =HClO+HCO3- 一定温度下,1L0.5mol·L-1NH4Cl溶液与2L0.25mol·L-1NH4Cl溶液含NH4+物质的量相同 常温下水电离出c(H+)×c(OH-)=10-20的溶液中:Na+、ClO-、SO42 -、NH
、Cl-能大量共存 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳: ClO-+CO2+ H2O =HClO+HCO3- 一定温度下,1L0.5mol·L-1NH4Cl溶液与2L0.25mol·L-1NH4Cl溶液含NH4+物质的量相同 常温下水电离出c(H+)×c(OH-)=10-20的溶液中:Na+、ClO-、SO42 -、NH 可能大量共存
可能大量共存
c(OH-)>c(H+) c(HCO3-)>c(NH4+) c(NH4+) + c(H+)= c(HCO3-) + 2c(CO32-) + c(OH-) c(H2CO3) + c(H+) = c(CO32-) + 2c(NH3·H2O) + c(OH-)
在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF 若将CO2 通入0.1 mol·L-1Na2CO3溶液中至溶液中性,则溶液中 2 c (CO32ˉ)+ c (HCO3ˉ)= 0.1 mol·L-1 根据上表, 水解方程式ClOˉ+ H2O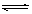 HClO + OHˉ的平衡常数K≈10ˉ7.6 向上述NaClO 溶液中通HF气体至恰好完全反应时:C.(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OHˉ)
HClO + OHˉ的平衡常数K≈10ˉ7.6 向上述NaClO 溶液中通HF气体至恰好完全反应时:C.(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OHˉ)
在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF 若将CO2 通入0.1 mol·L-1Na2CO3溶液中至溶液中性,则溶液中 2 c (CO32ˉ)+ c (HCO3ˉ)= 0.1 mol·L-1 根据上表, 水解方程式ClOˉ+ H2O HClO + OHˉ的平衡常数K≈10ˉ7.6 向上述NaClO 溶液中通HF气体至恰好完全反应时: c(Na+)>c(F.ˉ)>c(H+)>c(HClO)>c(OHˉ)
HClO + OHˉ的平衡常数K≈10ˉ7.6 向上述NaClO 溶液中通HF气体至恰好完全反应时: c(Na+)>c(F.ˉ)>c(H+)>c(HClO)>c(OHˉ)
向蒸馏水中滴加浓H2SO4时,KW不变 常温下,0.005mol·L-1Ba(OH)2溶液pH为12 Na2CO3水解的离子方程式为:CO32- + 2H2O H2CO3 + 2OH- NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
H2CO3 + 2OH- NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
常温下,AgCl 在饱和 NaCl 溶液中的 K.SP 比在纯水中的 K.SP 小 向 AgCl 的悬浊液中加入 KI 溶液,沉淀由白色转化为黄色 向 AgCl 的饱和溶液中加入 NaCl 晶体,有 AgCl 析出且溶液中 c(Ag+)=c(Cl-) 将 0.001 mol·L-1 的 AgNO3 溶液滴入 KCl 和 KI 的混合溶液中,一定先产生 AgI 沉淀
常温下,AgCl 在饱和 NaCl 溶液中的 K.SP 比在纯水中的 Ksp小 向 AgCl 的悬浊液中加入 KI 溶液,沉淀由白色转化为黄色 向 AgCl 的饱和溶液中加入 NaCl 晶体,有 AgCl 析出且溶液中 c(Ag+)=c(Cl-) 将 0.001 mol·L-1 的 AgNO3 溶液滴入 KCl 和 KI 的混合溶液中,一定先产生 AgI 沉淀
向蒸馏水中滴加浓H2SO4时,KW不变 常温下,0.005mol·L-1Ba(OH)2溶液pH为12 Na2CO3水解的离子方程式为:CO32- + 2H2O H2CO3 + 2OH- NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
H2CO3 + 2OH- NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同

 H2CO3 + 2OH- NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
H2CO3 + 2OH- NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
 、Cl-能大量共存 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳: ClO-+CO2+ H2O =HClO+HCO3- 一定温度下,1L0.5mol·L-1NH4Cl溶液与2L0.25mol·L-1NH4Cl溶液含NH4+物质的量相同 常温下水电离出c(H+)×c(OH-)=10-20的溶液中:Na+、ClO-、SO42 -、NH
、Cl-能大量共存 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳: ClO-+CO2+ H2O =HClO+HCO3- 一定温度下,1L0.5mol·L-1NH4Cl溶液与2L0.25mol·L-1NH4Cl溶液含NH4+物质的量相同 常温下水电离出c(H+)×c(OH-)=10-20的溶液中:Na+、ClO-、SO42 -、NH 可能大量共存
可能大量共存
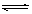 HClO + OHˉ的平衡常数K≈10ˉ7.6 向上述NaClO 溶液中通HF气体至恰好完全反应时:C.(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OHˉ)
HClO + OHˉ的平衡常数K≈10ˉ7.6 向上述NaClO 溶液中通HF气体至恰好完全反应时:C.(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OHˉ)
 HClO + OHˉ的平衡常数K≈10ˉ7.6 向上述NaClO 溶液中通HF气体至恰好完全反应时: c(Na+)>c(F.ˉ)>c(H+)>c(HClO)>c(OHˉ)
HClO + OHˉ的平衡常数K≈10ˉ7.6 向上述NaClO 溶液中通HF气体至恰好完全反应时: c(Na+)>c(F.ˉ)>c(H+)>c(HClO)>c(OHˉ)
 H2CO3 + 2OH- NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
H2CO3 + 2OH- NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
 H2CO3 + 2OH- NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
H2CO3 + 2OH- NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同