你可能感兴趣的试题
铅蓄电池放电工作原理为:Pb+PbO2+2H2SO4 =2PbSO4+2H2O, 其充电时阴极反应式为:PbSO4+2e— = Pb+SO42— 碱性锌锰干电池放电时,负极反应式可以写为:Zn—2e— = Zn2+ 碱性镍氢电池放电时正极反应式为:H2—2e—+2OH— = 2H2O 某锂离子电池的总反应式为:Li+2Li , 则其充电时阳极反应式为:2Li0.85NiO2 — e— = 2Li0.35NiO2 + Li+
, 则其充电时阳极反应式为:2Li0.85NiO2 — e— = 2Li0.35NiO2 + Li+
NiO(OH) Ni(OH) 2 H2 H2和NiO(OH)
在使用过程中,此电池要不断补充水 放电时,NiOOH在电极上发生氧化反应 充电时,阳极反应式为Ni(OH)2-e-+OH-===NiOOH+H2O 充电时,阴极区的电解质溶液的pH降低
NiO(OH) Ni(OH) 2 H2 H2和NiO(OH)
H2是单质 NiO (OH)是氧化物 Ni(OH)2中Ni化合价为+2价 参加反应的H2、NiO(OH)的质量比为1∶92
NiO(OH) Ni(OH)2 H2 H2和NiO(OH)
电池放电时,电池负极周围溶液的pH不断增大
电池放电时,镍元素被氧化
电池充电时,氢元素被还原
电池放电时,氢气在正极反应
NiO(OH) Ni(OH)2 H2 H2和NiO(OH)
电池充电时氢原子被氧化 电池放电时正极为NiOOH 电池充电时,与电源负极相连的电极反应为: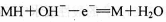 电池放电时,负极反应为:
电池放电时,负极反应为:
放电时电池内部H+向负极移动 充电时,将电池的负极与外接电源的正极相连 充电时阳极反应为Ni(OH)2+ OH-- e-====NiOOH+H2O 放电时负极的电极反应式为MHn-ne- = M+nH+
NiO(OH) Ni(OH)2 H2 H2和NiO(OH)
放电过程中负极的电极反应式:MH + OH--e-=== H2O +M. 放电过程中OH-从正极向负极迁移 放电时若有1 molM.生成,则转移的电子数目为N.A. (N.A.为阿伏伽德罗常数的值) NiMH电池中不能用KOH溶液作为电解质溶液
铅蓄电池放电工作原理为:Pb+PbO2+2H2SO4 =2PbSO4+2H2O, 其充电时阴极反应式为:PbSO4+2e— = Pb+SO42— 碱性锌锰干电池放电时,负极反应式可以写为:Zn—2e— = Zn2+ 碱性镍氢电池放电时正极反应式为:H2—2e—+2OH— = 2H2O 某锂离子电池的总反应式为:Li+2Li , 则其充电时阳极反应式为:2Li0.85NiO2 — e— = 2Li0.35NiO2 + Li+
, 则其充电时阳极反应式为:2Li0.85NiO2 — e— = 2Li0.35NiO2 + Li+
NiO(OH) Ni(OH)2 H2 H2和NiO(OH)
NiO(OH) Ni(OH) 2 H2 H2和NiO(OH)
NiO(OH) Ni(OH)2 H2 H2和NiO(OH)
电池放电时,电池负极周围的溶液pH不断增大
电池放电时,镍元素被氧化
电池放电时,镍元素被还原
电池放电时,H2是正极
在上坡或加速时,乙电极周围溶液的pH将减小 在上坡或加速时,溶液中的K+向甲电极迁移 在刹车和下坡时,甲电极的电极反应式为:2H2O+2e- H2↑+2OH- 在刹车和下坡时,乙电极增重
H2↑+2OH- 在刹车和下坡时,乙电极增重

 , 则其充电时阳极反应式为:2Li0.85NiO2 — e— = 2Li0.35NiO2 + Li+
, 则其充电时阳极反应式为:2Li0.85NiO2 — e— = 2Li0.35NiO2 + Li+
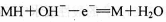 电池放电时,负极反应为:
电池放电时,负极反应为:
 , 则其充电时阳极反应式为:2Li0.85NiO2 — e— = 2Li0.35NiO2 + Li+
, 则其充电时阳极反应式为:2Li0.85NiO2 — e— = 2Li0.35NiO2 + Li+
 H2↑+2OH- 在刹车和下坡时,乙电极增重
H2↑+2OH- 在刹车和下坡时,乙电极增重