你可能感兴趣的试题
该溶液中,H.+、NH 、SO
、SO 、Br-可以大量共存 该溶液中,Ag+、K.+、NO
、Br-可以大量共存 该溶液中,Ag+、K.+、NO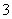 、CH3CHO可以大量共存 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为: 2Fe2++ClO-+2H+===Cl-+2Fe3++H2O 向该溶液中加入浓盐酸,每产生1 mol Cl2,转移电子约为6.02×1023个
、CH3CHO可以大量共存 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为: 2Fe2++ClO-+2H+===Cl-+2Fe3++H2O 向该溶液中加入浓盐酸,每产生1 mol Cl2,转移电子约为6.02×1023个
溶液一定是混合物 溶液中一定含有水 溶液都是无色透明的 凡是均一、稳定的液体一定是溶液
等浓度等体积的强酸与强碱溶液混合后,溶液的pH=7 pH=2的盐酸与pH=12的氨水等体积混合后所得溶液显中性 pH=10的Ba(OH)2溶液和pH=13的NaOH溶液等体积混合后溶液的pH=10.7(lg 2=0.3) 将10 mL pH=a的盐酸与100 mL pH=b的Ba(OH)2溶液混合后恰好中和,则a+b=13
0.1 mol·L-1的KHA溶液,其pH=10:c(HA-)> c(OH-)> c(H+)> c(A2-) pH=2的盐酸和pH=12的Ba(OH)2溶液混合后:pH=7 100mL 1.0 mol·L-1 Fe(NO3)2溶液和100mL 2.0 mol·L-1 HNO3溶液混合后: c(NO3-)=2.0 mol·L-1 pH相等的CH3COONa、NaClO、NaHCO3三种溶液:c(NaHCO3) >c(CH3COONa) >c(NaClO)
HClO是弱酸,所以NaClO是弱电解质 HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 电解H2O溶液得到22.4L H2(标准状况),理论上需要转移NA个电子
NaClO发生水解反应,使溶液呈碱性 用 NaOH 溶液吸收Cl2可得到该溶液 该溶液有漂白杀菌作用,可用于环境消毒 该溶液与洁厕灵(主要成分为HCl)混合,去污效果更佳
该溶液中,H+、NH4+、SO42-、Br-可以大量共存 该溶液中,Ag+、K+、NO3-、CH3CHO可以大量共存 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+ = Cl-+2Fe3++H2O 向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个
该溶液中,H+、NH 、SO
、SO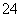 、Br-可以大量共存 该溶液中,Ag+、K+、NO
、Br-可以大量共存 该溶液中,Ag+、K+、NO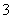 、CH3CHO可以大量共存 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+=== Cl-+2Fe3++H2O 向该溶液中加入浓盐酸,每产生1 molCl2,转移电子约为6.02×1023个
、CH3CHO可以大量共存 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+=== Cl-+2Fe3++H2O 向该溶液中加入浓盐酸,每产生1 molCl2,转移电子约为6.02×1023个
该溶液中,H+、NH+ 4、SO42-、Br-可以大量共存 该溶液中,Ag+、K+、NO3-、CH3CHO可以大量共存 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为 2Fe2++ClO-+2H+==Cl-+2Fe3++H2O 向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个
HClO是弱酸,所以NaClO是弱电解质 向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 电解NaCl溶液得到22.4LH2(标准状况),理论上需要转移NA个电子(NA表示阿伏加德罗常数)
酸性:HCN>HClO pH:HClO<HCN 浓度:c(CN-)<c(ClO-) 与NaOH恰好完全反应时,消耗NaOH的物质的量:HClO>HCN
NaClO和NaCl混合溶液中,H+、NH、SO、Br-可以大量共存 NaClO和NaCl混合溶液中,Ag+、K+、NO、CH3CHO可以大量共存 CuSO4溶液中Na+、NH、NO、Mg2+可以大量共存 中性溶液中可能大量存在Fe3+、K+、Cl-、SO
闻到气味因为微粒在不断运动 NaClO2由NaCl和O.2构成的 NaClO2中氯元素的化合价为+3价 NaClO2由三种元素组成的
鉴别NaCl溶液与稀盐酸,可加入无色酚酞溶液 用燃烧并在火焰上方罩干冷的烧杯的方法鉴别氢气和甲烷 鉴别羊毛线和棉线的方法是点燃闻气味 除去CO2中CO杂质,可以将混合气体通过足量 .
HClO是弱酸,所以NaClO是弱电解质 向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 电解NaCl溶液得到22.4 LH2(标准状况),理论上需要转移N.A个电子(N.A表示阿伏加德罗常数)
0.1 mol·L-1的KHA溶液,其pH=10:c(HA-)> c(OH-)> c(H+)> c(A2-) pH=2的盐酸和pH=12的Ba(OH)2溶液混合后:pH=7 100mL1.0 mol·L-1Fe(NO3)2溶液和100mL2.0 mol·L-1 HNO3溶液混合后:c(NO3-)=2.0 mol·L-1 pH相等的CH3COONa、NaClO、NaHCO3三种溶液:c(NaHCO3) >c(CH3COONa) >c(NaClO)
a为正极,b为负极;NaClO和NaCl
a为负极,b为正极;NaClO和NaCl
a为阳极,b为阴极;HClO和NaCl
a为阴极,b为阳极;HClO和NaCl
该溶液中,H.+、NH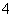 、SO
、SO 、Br-可以大量共存 该溶液中,Ag+、K.+、NO
、Br-可以大量共存 该溶液中,Ag+、K.+、NO 、CH3CHO可以大量共存 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为: 2Fe2++ClO-+2H+===Cl-+2Fe3++H2O 向该溶液中加入浓盐酸,每产生1 mol Cl2,转移电子约为6.02×1023个
、CH3CHO可以大量共存 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为: 2Fe2++ClO-+2H+===Cl-+2Fe3++H2O 向该溶液中加入浓盐酸,每产生1 mol Cl2,转移电子约为6.02×1023个
向FeCl3溶液和Fe(OH)3胶体中加入饱和NaCl溶液都不产生沉淀 用滤纸过滤分离FeCl3溶液和Fe(OH)3胶体的混合物 FeCl3饱和溶液与NaOH浓溶液混合即可制备得到Fe(OH)3胶体
向Fe(OH)3胶体中逐滴滴入盐酸先产生沉淀,后沉淀溶解
将植物油与水混合,充分振荡后得到的是溶液
配制溶液时,搅拌溶液可以增大溶质的溶解度 将120 g KCl溶液蒸干得到20g KCl固体,则KCl的溶解度为20g KNO3中混有少量NaCl,可采用降温结晶法提纯KNO3

 、SO
、SO 、Br-可以大量共存 该溶液中,Ag+、K.+、NO
、Br-可以大量共存 该溶液中,Ag+、K.+、NO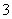 、CH3CHO可以大量共存 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为: 2Fe2++ClO-+2H+===Cl-+2Fe3++H2O 向该溶液中加入浓盐酸,每产生1 mol Cl2,转移电子约为6.02×1023个
、CH3CHO可以大量共存 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为: 2Fe2++ClO-+2H+===Cl-+2Fe3++H2O 向该溶液中加入浓盐酸,每产生1 mol Cl2,转移电子约为6.02×1023个
 、SO
、SO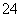 、Br-可以大量共存 该溶液中,Ag+、K+、NO
、Br-可以大量共存 该溶液中,Ag+、K+、NO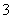 、CH3CHO可以大量共存 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+=== Cl-+2Fe3++H2O 向该溶液中加入浓盐酸,每产生1 molCl2,转移电子约为6.02×1023个
、CH3CHO可以大量共存 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+=== Cl-+2Fe3++H2O 向该溶液中加入浓盐酸,每产生1 molCl2,转移电子约为6.02×1023个
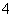 、SO
、SO 、Br-可以大量共存 该溶液中,Ag+、K.+、NO
、Br-可以大量共存 该溶液中,Ag+、K.+、NO 、CH3CHO可以大量共存 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为: 2Fe2++ClO-+2H+===Cl-+2Fe3++H2O 向该溶液中加入浓盐酸,每产生1 mol Cl2,转移电子约为6.02×1023个
、CH3CHO可以大量共存 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为: 2Fe2++ClO-+2H+===Cl-+2Fe3++H2O 向该溶液中加入浓盐酸,每产生1 mol Cl2,转移电子约为6.02×1023个