
 向明矾溶液中加入过量NaOH 溶液会产生大量白色沉淀
向明矾溶液中加入过量NaOH 溶液会产生大量白色沉淀 向磷酸二氢铵溶液中加入足量的氢氧化钠溶液:
向磷酸二氢铵溶液中加入足量的氢氧化钠溶液: 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:
向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:
 用浓盐酸酸化的
用浓盐酸酸化的 溶液与
溶液与 反应,证明
反应,证明 具有还原性,发生反应的离子方程式为:
具有还原性,发生反应的离子方程式为: 向小苏打溶液中加入过量的澄清石灰水,发生反应的离子方程式为:
向小苏打溶液中加入过量的澄清石灰水,发生反应的离子方程式为: 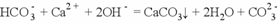 向明矾溶液中滴加
向明矾溶液中滴加 溶液至沉淀质量最大时,发生反应的离子方程式为:
溶液至沉淀质量最大时,发生反应的离子方程式为: 

 向氢氧化亚铁中加入足量的稀硝酸:
向氢氧化亚铁中加入足量的稀硝酸: 向磷酸二氢铵溶液中加入足量的氢氧化钠溶液:
向磷酸二氢铵溶液中加入足量的氢氧化钠溶液: 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:
向CH2BrCOOH中加入足量的氢氧化钠溶液并加热: CH2BrCOO-+H2O
CH2BrCOO-+H2O
 +2Ba2++4OH-===2BaSO4↓+AlO- 2+2H2O 向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+===Fe2++2H2O 向碳酸氢铵溶液中加入足量的氢氧化钠溶液:NH
+2Ba2++4OH-===2BaSO4↓+AlO- 2+2H2O 向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+===Fe2++2H2O 向碳酸氢铵溶液中加入足量的氢氧化钠溶液:NH +OH-===NH3·H2O
+OH-===NH3·H2O  向CH2BrCOOH中加入足量的氢氧化钠溶液并加热: CH2BrCOOH+OH- CH2BrCOO-+H2O
向CH2BrCOOH中加入足量的氢氧化钠溶液并加热: CH2BrCOOH+OH- CH2BrCOO-+H2O