


 和 的核外电子数不同; 和 分别含有126和127个质子
和 的核外电子数不同; 和 分别含有126和127个质子
 Bi元素的相对原子质量是209.0 Bi原子核内质子数是209 Bi原子核内中子数83
Bi元素的相对原子质量是209.0 Bi原子核内质子数是209 Bi原子核内中子数83

 Bi和
Bi和
 Bi都含有83个中子
Bi都含有83个中子 
 Bi和
Bi和
 Bi互为同位素
Bi互为同位素 
 Bi和
Bi和
 Bi的核外电子数不同
Bi的核外电子数不同 
 Bi和
Bi和
 Bi分别含有126和127个质子
Bi分别含有126和127个质子
 Bi和
Bi和 Bi互为同素异形体
Bi互为同素异形体  Bi和
Bi和 Bi互为同位素
Bi互为同位素  Bi和
Bi和 Bi的核外电子数不同
Bi的核外电子数不同  Bi和
Bi和 Bi分别含有126和127个质子
Bi分别含有126和127个质子
 Bi和
Bi和 Bi的核外电子数不同
Bi的核外电子数不同  Bi和
Bi和 Bi分别含有126和127个质子
Bi分别含有126和127个质子  Bi和
Bi和 Bi互为同位素
Bi互为同位素  Bi和
Bi和 Bi都含有83个中子
Bi都含有83个中子


 Bi和
Bi和 Bi都含有83个中子
Bi都含有83个中子
 Bi和
Bi和 Bi互为同位素
Bi互为同位素
 Bi和
Bi和 Bi的核外电子数不同
Bi的核外电子数不同
 Bi和
Bi和 Bi分别含有126和127个质子
Bi分别含有126和127个质子
 和
和 是同一种核素
是同一种核素  和
和 的中子数相同
的中子数相同  和
和 互称为同位素
互称为同位素  和
和 的质量数相同
的质量数相同
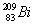 和
和 互为同位素
互为同位素 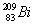 和
和 都含有83个中子
都含有83个中子 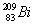 和
和 分别含有126和127个质子
分别含有126和127个质子 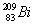 和
和 的核外电子数不同
的核外电子数不同
 和
和 是同一种核素
是同一种核素  和
和 的中子数相同
的中子数相同  和
和 互称为同位素
互称为同位素  和
和 的质量数相同
的质量数相同
 Bi元素的相对原子质量是209.0 Bi原子核内质子数是209 Bi原子核内中子数83
Bi元素的相对原子质量是209.0 Bi原子核内质子数是209 Bi原子核内中子数83