你可能感兴趣的试题
阳极反应为Fe-2e- = Fe2+ 过程中有Fe(OH)3沉淀生成 电路中每转移12mol电子,最多有1mol Cr2O72-被还原 如果石墨做阴阳极,电解过程不变
阳极反应为Fe-2e-==Fe2+ 电解过程中溶液pH不会变化 过程中有Fe(OH)3沉淀生成 电路中每转移12mol电子,最多有1 mol Cr2O72-被还原
阳极反应为Fe - 2e- = Fe2+ 过程中有Fe(OH)3沉淀生成 电路中每转移12mol电子,最多有1mol Cr2O72-被还原 如果石墨做阴阳极,电解过程不变
阳极材料也可以是Cu 阴极每产生3molH2,则有1mol Cr2O72-被还原 一段时间后溶液中发生反应Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 电解最后阶段需要加碱,使溶液中的阳离子转化为沉淀
阳极反应为Fe-2e-=Fe2+ 电解过程中溶液pH不会变化 过程中有Fe(OH)3沉淀生成 电路中每转移12 mol电子,最多有1 mol Cr2O72-被还原
电解时以纯铜作阳极 电解时阴极发生氧化反应 粗铜连接电源负极,电极反应是Cu -2e-=Cu2+ 电解结束,电解槽底部会形成含少量Ag、Au等阳极泥
电解法是在直流电场作用下,利用电极上产生的氧化还原反应,去除水中污染物的方法。 用于进行电解的装置叫电解槽。 电解法是在交流电场作用下,利用电极上产生的交替的氧化和还原作用,使污染物得到去除。 电解装置阴极与电源的负极相联,阳与电极的正极相联。
电解槽中H+向阳极移动 阳极的电极反应式是:Fe-3e-= Fe3+ 电解一段时间后,阴极区溶液的pH升高 阳极的铁板可用石墨代替 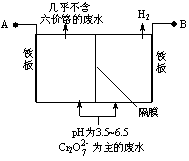
热还原法、热分解法、电解法 电解法、热还原法、热分解法 热分解法、热还原法、电解法 电解法、热分解法、热还原法
沉淀法和气化法 沉淀法和电解法 气化法和电解法 沉淀法、气化法和电解法

