你可能感兴趣的试题
HA为强 该混合溶液的pH=7.0 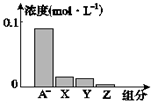 该混合溶液中c(Aˉ)+c(Y)=c(Na+) 图中X.表示HA,Y.表示OH-,Z.表示H+
该混合溶液中c(Aˉ)+c(Y)=c(Na+) 图中X.表示HA,Y.表示OH-,Z.表示H+
若混合前酸、碱pH之和等于14,则HA一定是弱酸 若混合前酸、碱物质的量浓度相同,则BOH一定是弱碱 溶液中水的电离程度:混合溶液>纯水>BOH溶液 混合溶液中离子浓度一定满足:c(B+)>c(A-)>c(H+)>c(OH-)
将1mLpH=5的稀盐酸加水稀释到100mL 0.1mol・L-1的某二元酸和0.1mol・L-1的某二元强碱等体积混合 pH=2的某一元酸和 pH=12的某一元碱等体积混合 pH=2的某二元强酸和pH=12的某一元强碱等体积混合
①溶液中:c(A-)>c(Na+)>c(OH-)>c(H+) ①溶液中:c(HA)+c(A-)=0.1mol/L 常温下,0.1mol/LHA溶液的pH=1 0.1mol/LHA溶液中:c(HA)>c(A-)
c(B+)=c(A-)>c(OH-)>c(H+) c(A-)>c(B+)>c(H+)>c(OH-) c(B+)+c(H+)=c(A-)+c(OH-) c(B+)>c(A-)>c(H+)>c(OH-)
HA的电离方程式为: 不考虑其他组的实验结果,
不考虑其他组的实验结果, ③组实验中,混合溶液中
③组实验中,混合溶液中 ①组实验中,混合溶液中
①组实验中,混合溶液中
若V1>V2,则说明HA的酸性比HB的酸性强 若V1>V2,则说明HA的酸性比HB的酸性弱 因为两种酸溶液的pH相等,故V1一定等于V2 若将两种酸溶液等体积混合,混合酸溶液的pH一定等于2
a>9 在乙组混合液中由水电离出的c(OH-)=10-5mol·L-1 c1=0.2 丁组混合液:c(Na+)>c(A-)>c(H+)>c(OH-)
从甲组情况分析,若a=7,则HX为强酸;若a>7,则HX为弱酸 在乙组混合溶液中,离子浓度c(X-)=c(Na+) 从丙组实验结果分析,HX是弱酸 丁组实验所得混合溶液中,由水电离出的c(OH-)=10-10 mol/L
该溶液中:c2(H+)≠c(H+)·c(A-)+Kw 由pH=3的HA溶液与pH=11的NaOH溶液等体积混合,所得溶液中: c(Na+)>c(A-)>c(OH-)>c(H+) 浓度均为0.1 mol·L-1的HA和NaA溶液等体积混合,所得溶液中: c(A-)>c(HA)>c(Na+)>c(OH-)>c(H+) 0.1 mol·L-1 HA溶液与0.05 mol·L-1 NaOH溶液等体积混合,所得溶液中: 2c(H+)+c(HA)===c(A-)+2c(OH-)
c1=0.2 丁组混合液:c(Na+)>c(A-)>c(H+)>c(OH-) a>9 在乙组混合液中由水电离出的c(OH-)=10-5mol·L-1
0.1mol·L-1的HA溶液中由水电离出的c(H+)> 1×10-13mol/L c1一定大于0.2 mol·L-1 甲反应后的溶液中:HA占含A-微粒总数的0.01%  乙反应后的溶液中:c(Na+) < c(HA) + c(A-)
乙反应后的溶液中:c(Na+) < c(HA) + c(A-)
该溶液中:2c (H.+)=c(A.﹣)+c(OH﹣) 由pH=3的HA溶液与pH=11的NaOH溶液等体积混合,所得溶液中: c(Na+)>c(A.﹣)>c(OH﹣)>c(H.+) 浓度均为0.1 mol•L﹣1的HA和NaA溶液等体积混合,所得溶液中: c(A.﹣)>c(HA)>c(Na+)>c(OH﹣)>c(H.+) 0.1 mol•L﹣1 HA溶液与0.05 mol•L﹣1 NaOH溶液等体积混合,所得溶液中: 2c(H.+)+c(HA)═c(A.﹣)+2c(OH﹣)
若混合前酸、碱溶液的pH之和等于14,则HA是强酸
若酸、碱溶液的物质的量浓度相等,则BOH是弱碱
水的电离程度:混合溶液>纯水>BOH溶液
混合后溶液中的离子浓度关系:c(B+)>c(A-)>c(H+)>c(OH-)
中和一定的NaOH溶液,需消耗与NaOH等物质的量的HA
将pH=4的HA溶液稀释10倍,溶液pH小于5
将pH=2的HA溶液与pH=12的NaOH溶液等体积混合后,溶液呈酸性
将0.1mol/L的HA溶液与0.1 mol/L的NaOH溶液等体积混合后,溶液呈碱性
若V1>V2,则说明HA的酸性比HB的酸性强
若V1>V2,则说明HA的酸性比HB的酸性弱
因为两种酸溶液的pH相等,故V1一定等于V2
若将两种酸溶液等体积混合,混合溶液的pH一定等于2

 该混合溶液中c(Aˉ)+c(Y)=c(Na+) 图中X.表示HA,Y.表示OH-,Z.表示H+
该混合溶液中c(Aˉ)+c(Y)=c(Na+) 图中X.表示HA,Y.表示OH-,Z.表示H+
 不考虑其他组的实验结果,
不考虑其他组的实验结果, ③组实验中,混合溶液中
③组实验中,混合溶液中 ①组实验中,混合溶液中
①组实验中,混合溶液中
 乙反应后的溶液中:c(Na+) < c(HA) + c(A-)
乙反应后的溶液中:c(Na+) < c(HA) + c(A-)