你可能感兴趣的试题
反应停止了 正逆反应的速率均为零 正逆反应都还在继续进行 正逆反应的速率相等
反应停止了 正逆反应的速率均为零 正逆反应都还在继续进行 正逆反应的速率相等
使用催化剂,可以加快反应速率
可逆反应A(g)⇌B(g)+C(g),增大压强正反应速率和逆反应速率增大
对达到平衡的一个放热的可逆反应,若降低温度正反应速率减小,逆反应速率增大
参加反应物质的性质是决定化学反应速率的主要因素
正反应的速率与逆反应的速率相同程度增加 只增加正反应的速率 只增加逆反应速率 正反应速率比逆速率增加得快
吸热可逆反应 吸热不可逆反应 放热不可逆反应 放热可逆反应
可逆反应达到平衡的重要特征是各物质的反应速率相等。 在可逆反应里,正反应的速率是正值,逆反应的速率是负值。 对于H2+I2  2HI,当有1mol H-H键断裂的同时,有2mol H-I键生成,说明此可逆反应已达到平衡。 在一定条件下,当可逆反应的正反应速率与逆反应速率相等时,反应物和生成物的浓度不再发生变化,这就是该反应所达到的限度。
2HI,当有1mol H-H键断裂的同时,有2mol H-I键生成,说明此可逆反应已达到平衡。 在一定条件下,当可逆反应的正反应速率与逆反应速率相等时,反应物和生成物的浓度不再发生变化,这就是该反应所达到的限度。
化学反应速率是对可逆反应而言的,非可逆反应不谈化学反应速率 在可逆反应中,正反应的化学反应速率是正值,逆反应的化学反应速率是负值 同一化学反应中,化学反应速率可用反应物浓度的改变表示,也可用生成物浓度的改变表示,其值可能相同,也可能不同 化学反应速率的单位可以是g/(L·s),也可以是kg/(L·s)
可逆反应的特征是正反应速率等于逆反应速率 在其他条件不改变时,增大压强对溶液间反应几乎无影响 温度升高,可以使可逆反应正反应速率加快,但逆反应速率可以不变 化学反应的限度是不可改变的
决定化学反应速率的主要因素是反应物的性质 一定条件下的可逆反应建立平衡时,反应物浓度与生成物浓度相等 在可逆反应中正反应速率等于逆反应速率 对于任何化学反应来说,反应速率越大,反应的现象就越明显
可逆反应的特征是正反应速率等于逆反应速率 在其他条件不改变时,增大压强对溶液间反应几乎无影响 温度升高,可以使可逆反应正反应速率加快,但逆反应速率可以不变 使用催化剂可以使原来不能发生的反应变为可能发生了
可逆反应在同一条件下既向正反应方向进行同时也向逆方向反应进行。 可逆反应中,反应物不可能完全转化为生成物 可逆反应达到平衡时,反应物和生成物的浓度相等 化学平衡状态时,正反应速率等于逆反应速率
只影响正反应速率 只影响逆反应速率 对正逆反应速率都有影响 对正逆反应速率都没有影响
可逆反应正反应速率大于逆反应速率 可逆反应正反应速率小于逆反应速率 可逆反应正反应速率等于逆反应速率 逆反应速率为 0
反应速率越大,平衡常数也越大 可逆反应处于平衡状态时,正反应速率等于逆反应速率 可逆反应处于平衡状态时,各反应物和生成物的浓度相等 平衡常数与反应物初始浓度无关,而转化率的数值却随初始浓度改变
反应停止了 正逆反应的速率均为零 正逆反应都还在继续进行 正逆反应的速率相等
可逆反应达到平衡时,正反应的平衡常数等于逆反应的平衡常数 可逆反应达到平衡时,正反应速率等于逆反应速率 可逆反应达到平衡时,参与反应的各物质的浓度保持不变 可逆反应达到平衡时,产物浓度幂的乘积与反应物浓度幂的乘积之比,在一定温度下是常数
正反应的速率与逆反应的速率相同程度增加 只增加正反应的速率 只增加逆反应速率 正反应速率比逆速率增加得快
(g)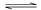 (g)+C(g),增大压强,正反应速率减小,逆反应速率增大 ⑦对达到平衡的一个放热的可逆反应,若降温,则正反应速率减小,逆反应速率增大 A. 2 个 B. 3 个 4 个 5个
(g)+C(g),增大压强,正反应速率减小,逆反应速率增大 ⑦对达到平衡的一个放热的可逆反应,若降温,则正反应速率减小,逆反应速率增大 A. 2 个 B. 3 个 4 个 5个

 2HI,当有1mol H-H键断裂的同时,有2mol H-I键生成,说明此可逆反应已达到平衡。 在一定条件下,当可逆反应的正反应速率与逆反应速率相等时,反应物和生成物的浓度不再发生变化,这就是该反应所达到的限度。
2HI,当有1mol H-H键断裂的同时,有2mol H-I键生成,说明此可逆反应已达到平衡。 在一定条件下,当可逆反应的正反应速率与逆反应速率相等时,反应物和生成物的浓度不再发生变化,这就是该反应所达到的限度。
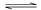 (g)+C(g),增大压强,正反应速率减小,逆反应速率增大 ⑦对达到平衡的一个放热的可逆反应,若降温,则正反应速率减小,逆反应速率增大 A. 2 个 B. 3 个 4 个 5个
(g)+C(g),增大压强,正反应速率减小,逆反应速率增大 ⑦对达到平衡的一个放热的可逆反应,若降温,则正反应速率减小,逆反应速率增大 A. 2 个 B. 3 个 4 个 5个