你可能感兴趣的试题
该溶液中,H+、NH4+、SO42-、Br-可以大量共存 该溶液中,Ag+、K+、NO3-、CH3CHO可以大量共存 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+ = Cl-+2Fe3++H2O 向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个
漂白粉能漂白是因为Ca(ClO)2中的 ClO-有强氧化性 明矾能够杀菌消毒是利用了胶体的吸附性 氢氧化铝、碳酸镁、小苏打等可用于治疗胃酸过多 二氧化硅可用于制造光导纤维
滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,原溶液中无NH4+ 向Ca(ClO)2溶液通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 光照氯水有气泡冒出,该气体为Cl2 实验室可用右图所示装置制取饱和氨水 
若某温度下,反应后c(Cl-)∶c(ClO3-)=6∶1,则溶液中c(ClO-)∶c(ClO3-)=1∶1 参加反应的KOH的物质的量等于2a mol 改变温度,产物中KClO3的最大理论产量为0.5 a mol 改变温度,反应中转移电子的物质的量n(e-)的范围:a mol≤n(e-)≤ mol
mol
稀硝酸和氢氧化亚铁反应的离子方程式:Fe(OH)2+2H+=Fe2++2H2O 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3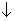 +2HClO 在酸性溶液中,Na+、K.+、MnO4-、Br-能大量共存 除去Mg2+溶液中的少量Fe3+,可以采用加入过量的氧化镁后过滤的方法
+2HClO 在酸性溶液中,Na+、K.+、MnO4-、Br-能大量共存 除去Mg2+溶液中的少量Fe3+,可以采用加入过量的氧化镁后过滤的方法
用食盐易清洗热水瓶中的水垢 用米汤检验含碘盐中的碘酸钾 漂白粉在空气中容易变质的原因是Ca(ClO)2见光易分解 利用丁达尔效应区别蛋白质溶液和食盐水
酸性:HCN>HClO pH:HClO<HCN 浓度:c(CN-)<c(ClO-) 与NaOH恰好完全反应时,消耗NaOH的物质的量:HClO>HCN
配制5%的医用葡萄糖溶液的一般步骤是计算、称量和溶解 自来水厂常用ClO2消毒,ClO2中氯元素的化合价为+2 为使水中的悬浮杂质沉降,可在水中加入适量的明矾 氢氧化钠溶液能导电是因为溶液中含有较多自由移动的离子
古代广泛使用铜器,是因为铜和铜盐性质稳定对人体无害
利用化学反应实现煤的气化和液化是清洁利用煤的重要途径
用淀粉溶液检测食盐中是否含有碘元素
漂白粉中的CaCl2和Ca(ClO)2与潮湿空气中的CO2反应而变质
①点所示溶液中只存在HClO的电离平衡 ①到②水的电离程度逐渐减小 I.-能在②点所示溶液中存在 ②点所示溶液中:c(Na+)=c(Cl-) + c(ClO-)
漂粉精的有效成分是Ca(ClO)2,Ca(ClO)2难分解,但漂粉精仍需密封保存 不锈钢是利用了牺牲阳极的阴极保护法来达到防止腐蚀的目的 无机非金属材料光导纤维能够被氢氟酸腐蚀 石灰石高温煅烧能分解,与此反应是熵增反应有关
碳酸氢钠溶液与少量石灰水反应:HCO3-+Ca2++OH-===CaCO3↓+H2O 硫氢化钠水解:HS-+H2O  H3O++S2- Ca(ClO)2溶液中通入少量的SO2:Ca2++2ClO-+SO2+H2O===2HClO+CaSO3↓ 铝片跟氢氧化钠溶液反应:2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑
H3O++S2- Ca(ClO)2溶液中通入少量的SO2:Ca2++2ClO-+SO2+H2O===2HClO+CaSO3↓ 铝片跟氢氧化钠溶液反应:2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑
滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,原溶液中无NH4+ 向Ca(ClO)2溶液通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 光照氯水有气泡冒出,该气体为Cl2 实验室可用右图所示装置制取饱和氨水
次氯酸钙溶液中通入少量SO2气体的离子方程式: Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO CaCl2既含有离子键,又含有非极性键。 SO2使KMnO4酸性溶液和滴有酚酞的NaOH溶液褪色的原理相同。 将铁屑溶于过量盐酸后,再加入硝酸锌,会有三价铁生成。
将Ca(ClO)2、Na2SO3、FeCl3溶液蒸干均得不到原溶质 保存氯化亚铁溶液时,在溶液中放少量铁粉,以防止Fe2+水解 室温下,向0.1mol/L的CH3COOH溶液中加入少量水溶液显碱性的物质,CH3COOH的电离程度一定增大 NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
①点所示溶液中只存在HClO的电离平衡 ②到③的过程中水的电离程度一定减小 ②点处表示氯气与氢氧化钠溶液恰好反应完全 ②点所示溶液中:c( Na+)=c(HClO)+2c(ClO-)
Ca(OH)2 具有碱性,可用于修复被酸雨浸蚀的土壤 SO2 具有漂白性,可用SO2 水溶液吸收Br2 蒸气 ClO2 具有强氧化性,可用于自来水的杀菌消毒 常温下铁能被浓硫酸钝化,可用铁质容器贮运浓硫酸
Ca(ClO)2用于消毒杀菌 用铝制容器盛装稀硫酸 Fe2O3用于炼铁 氧化镁作耐火材料
酸性:HCN>HClO
pH:HClO>HCN
浓度:[CN-]<[ClO-]
与NaOH恰好完全反应时,消耗NaOH的物质的量:HClO>HCN
次氯酸钙溶液中通入少量SO2气体的离子方程式 Ca2++2ClO-+SO2+H2O ═ CaSO3↓+2HClO CaCl2既含有离子键,又含有非极性键 SO2使KMnO4酸性溶液和滴有酚酞的NaOH溶液褪色的原理相同 将铁屑溶于过量盐酸后,再加入硝酸锌,会有三价铁生成


 mol
mol
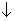 +2HClO 在酸性溶液中,Na+、K.+、MnO4-、Br-能大量共存 除去Mg2+溶液中的少量Fe3+,可以采用加入过量的氧化镁后过滤的方法
+2HClO 在酸性溶液中,Na+、K.+、MnO4-、Br-能大量共存 除去Mg2+溶液中的少量Fe3+,可以采用加入过量的氧化镁后过滤的方法
 H3O++S2- Ca(ClO)2溶液中通入少量的SO2:Ca2++2ClO-+SO2+H2O===2HClO+CaSO3↓ 铝片跟氢氧化钠溶液反应:2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑
H3O++S2- Ca(ClO)2溶液中通入少量的SO2:Ca2++2ClO-+SO2+H2O===2HClO+CaSO3↓ 铝片跟氢氧化钠溶液反应:2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑
