你可能感兴趣的试题
等于3mL 小于22mL 等于11mL 大于11mL
大于20mL 小于20mL
等于20mL 等于5mL
①>②>③>④>⑤
②>①>③>④>⑤
②>③>④>①>⑤
⑤>④>③>②>①
3种溶液pH的大小顺序是 ③>②>① 若将3种溶液稀释相同倍数,pH变化最大的是② 若分别加入25mL0.1mol・L-1盐酸后,pH最大的是① 若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
10mL0.1mol・L-1氨水与10mL0.1mol・L-1盐酸混合:[Cl-]>[NH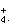 ]>[OH-]>[H+]
]>[OH-]>[H+]
10mL0.1mol・L-1NH4Cl溶液与5mL0.2mol・L-1NaOH溶液混合:[Na+]=[Cl-]>[OH-]>[H+]
10mL0.1mol・L-1CH3COOH溶液与5mL0.2mol・L-1NaOH溶液混合:[Na+]=[CH3COO-]>[OH-]>[H+]
10mL0.5mol・L-1CH3COONa溶液与6mL1mol・L-1盐酸混合:[Cl-]>[Na+]>[OH-]>[H+]
大于20 mL 小于20 mL 等于20 mL 等于5mL
0.2 mol・L.-1 0.5 mol・L.-1 0.1 mol・L.-1 0.25 mol・L.-1
1×10-7 mol・L.-1 0.1 mol・L.-1 0.1b/a mol・L.-1 0.lb/(a+b) mol・L.-1
4种溶液pH的大小顺序是③>②>④>① 向4种溶液中分别加入25mL 0.1 mol·L-1盐酸后,pH最大的是① 保持温度不变,将4种溶液稀释相同倍数,pH变化最大的是② pH均为9时,4种溶液的物质的量浓度的大小顺序是②>③>④>①
0.5 mol・L-1 0.05 mol・L-1 1 mol・L-1 0.1 mol・L-1
改用25mL 0.50mol/L盐酸跟25mL 0.55 mol/L NaOH溶液进行反应,求出的中和热数值和原来相同 酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌 装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热减少热量损失 实验中应记录测量出的最高温度
KOH溶液和KNO3溶液 50mL 0.5mol/L的HCl溶液和25mL 0.5mol/L的NaOH溶液 25mL 0.5mol/L的HAc溶液和50mL 0.5mol/L的NaOH溶液 30mL 0.1mol/L的NH3·H2O溶液和20mL 0.1mol/L的HCl溶液
取KOH、Ba(OH)2、Ca(OH)2溶液分别与酚酞试液作用,观察溶液颜色 取NaOH、NaCl、HCl溶液分别与酚酞试液作用,观察溶液颜色 向20.00ml滴有酚酞的0.10mol・L.¯1NaOH溶液中,逐滴滴加0.10mol・L.¯1HCl溶液25.00ml,观察溶液颜色变化 向25.00ml滴有酚酞的0.10 mol・L.¯1HCl中,逐滴滴加0.10 mol・L.¯1NaOH溶液20.00ml,观察溶液颜色变化
NaOH溶液起始浓度为0. 1 mol·L-1 A.>12.5 B.点溶液中c(Na+)一定等于c(CH3COO-) D.点溶液中: c(Na+)>c(CH3COO-)> c(CH3COOH)>c(H.+)>c(OH-)
1 mol・L-1甲酸溶液的c(H+)约为1×10-2 mol・L-1 甲酸能与水以任意比例混合 10 mL 1 mol・L-1甲酸恰好与10 mL 1 mol・L-1 NaOH溶液完全反应 在相同条件下,甲酸溶液的导电能力比硝酸溶液的弱
0.05mol・L―1 0.1mol・L―1 .0.2mol・L―1 0.3mol・L―1

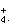 ]>[OH-]>[H+]
]>[OH-]>[H+]