你可能感兴趣的试题
T1<T2  T1℃时该反应的平衡常数为4.0L.2·mol-2 D
T1℃时该反应的平衡常数为4.0L.2·mol-2 D
容器Ⅰ、Ⅱ中正反应速率相同 容器Ⅰ、Ⅲ中反应的平衡常数相同 容器Ⅰ中CO 的物质的量和容器Ⅱ中的一样多 容器Ⅰ中CO 的转化率与容器Ⅱ中CO2 的转化率之和小于1
恒温恒容条件下,加入适当催化剂 恒温条件下,缩小反应容器体积 恒容条件下升高温度 恒温条件下,扩大反应容器体积
反应放出的热量为0.04a KJ
平衡时H2O的转化率为40%
若将容器的体积压缩为1L,有利于该反应平衡正向移动
判断该反应达到平衡的依据是CO、H2O、CO2、H2的浓度都相等
容器Ⅰ中CO 的物质的量比容器Ⅱ中的多 容器Ⅰ、Ⅲ中反应的平衡常数相同 容器Ⅰ、Ⅱ中正反应速率相同 容器Ⅰ中CO 的转化率与容器Ⅱ中CO2的转化率之和等于1
T1<T2 T1℃时该反应的平衡常数为4.0 L.2·mol-2 同一温度下,n(H2)/n(CO)越大,平衡常数也越大 相同条件下n(H2)/n(CO)越大,CO和H2的转化率也越大 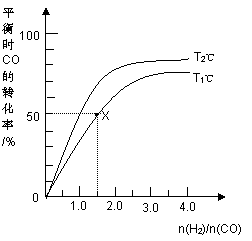
CO全部转化为乙醇 断4NA个H-H键的同时,生成46g乙醇 若反应在恒温恒容密闭容器中进行,容器中混合气体的密度不再改变 若反应在绝热恒容密闭容器中进行,容器中温度不再改变
将容器体积变为2L,Z.的平衡浓度变为原来的1/2 若增大压强,则物质Y.的转化率减小 若升高温度,X.的体积分数增大,则该反应的△H>0 以X.浓度变化表示的反应速率为0.01mol/(L·s)
容器I.、II中正反应速率相同 容器I、III中反应的平衡常数相同 容器I.中CO 的物质的量比容器II中的少 容器I.中CO 的转化率与容器II中CO2 的转化率之和小于1

 T1℃时该反应的平衡常数为4.0L.2·mol-2 D
T1℃时该反应的平衡常数为4.0L.2·mol-2 D

