你可能感兴趣的试题
容器Ⅰ、Ⅱ中正反应速率相同 容器Ⅰ、Ⅲ中反应的平衡常数相同 容器Ⅰ中CO 的物质的量和容器Ⅱ中的一样多 容器Ⅰ中CO 的转化率与容器Ⅱ中CO2 的转化率之和小于1
该反应的正反应吸热 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍 达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
容器Ⅰ、Ⅱ中正反应速率相同 容器Ⅰ、Ⅲ中反应的平衡常数相同 容器Ⅰ中CO的物质的量比容器Ⅱ中的多 容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和小于1
容器Ⅰ中CO 的物质的量比容器Ⅱ中的多 容器Ⅰ、Ⅲ中反应的平衡常数相同 容器Ⅰ、Ⅱ中正反应速率相同 容器Ⅰ中CO 的转化率与容器Ⅱ中CO2的转化率之和等于1
反应容器内压强不随时间变化 P.和S.的生成速率相等 反应容器内P.、Q.、R.、S.四者物质的量浓度为1:1:1:1 反应容器内总物质的量不随时间而变化
容器Ⅰ中前5 min的平均反应速率v(CO)= 0.16 mol·L-1·min-1 该反应正反应为吸热反应 容器Ⅱ中起始时Cl2的物质的量为0.55 mol 若起始时向容器Ⅰ加入CO 0.8 mol、Cl2 0.8 mol,达到平衡时CO转化率大于80%
该反应的正反应为吸热反应 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍 达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
容器Ⅰ、Ⅱ中正反应速率相同 容器Ⅰ、Ⅲ中反应的平衡常数相同 容器Ⅰ中CO的物质的量比容器Ⅱ中的少 容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和小于1
容器Ⅰ中前5min的中反应速率v(CO)=0.16mol·L-1·min-1 该反应的正反应为吸热反应 容器Ⅱ中起始时Cl2的物质的量为0.55mol 若起始时间容器Ⅰ中加入CO0.8mol、Cl2 0.8mol,达到平衡时CO的转化率大80%
CO全部转化为乙醇 断4NA个H-H键的同时,生成46g乙醇 若反应在恒温恒容密闭容器中进行,容器中混合气体的密度不再改变 若反应在绝热恒容密闭容器中进行,容器中温度不再改变
该反应的正反应吸热 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大 达到平衡时,容器Ⅱ中 小于容器Ⅰ 达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
小于容器Ⅰ 达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
CO合成甲醇的反应为吸热反应 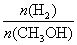 处于A.点的反应体系从T.1变到T.2,达到平衡时 增大 平衡常数K.=
处于A.点的反应体系从T.1变到T.2,达到平衡时 增大 平衡常数K.= 该反应在T.1时的平衡常数比T.2时的小
该反应在T.1时的平衡常数比T.2时的小
反应容器内压强不随时间变化 P.和S.的生成速率相等 反应容器内P.、Q.、R.、S.四者物质的量浓度为1:1:1:1 反应容器内总物质的量不随时间而变化
该反应的正反应放热 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍 达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
恒温恒容时,充入CO气体,达到新平衡时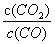 增大 容积不变时,升高温度,混合气体的平均相对分子质量减小 恒温恒容时,分离出部分SO2气体可提高MgSO4的转化率 恒温时,增大压强平衡逆向移动,平衡常数减小
增大 容积不变时,升高温度,混合气体的平均相对分子质量减小 恒温恒容时,分离出部分SO2气体可提高MgSO4的转化率 恒温时,增大压强平衡逆向移动,平衡常数减小
该反应的正反应吸热 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍 达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大

 小于容器Ⅰ 达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
小于容器Ⅰ 达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
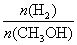 处于A.点的反应体系从T.1变到T.2,达到平衡时 增大 平衡常数K.=
处于A.点的反应体系从T.1变到T.2,达到平衡时 增大 平衡常数K.= 该反应在T.1时的平衡常数比T.2时的小
该反应在T.1时的平衡常数比T.2时的小
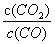 增大 容积不变时,升高温度,混合气体的平均相对分子质量减小 恒温恒容时,分离出部分SO2气体可提高MgSO4的转化率 恒温时,增大压强平衡逆向移动,平衡常数减小
增大 容积不变时,升高温度,混合气体的平均相对分子质量减小 恒温恒容时,分离出部分SO2气体可提高MgSO4的转化率 恒温时,增大压强平衡逆向移动,平衡常数减小