
 w 混合液的pH=7 a=b 混合液中c(OH-)=10-7mol/L
w 混合液的pH=7 a=b 混合液中c(OH-)=10-7mol/L
 w 混合液的pH=7 a=b 混合液中c(B+)=c(A-)+c(OH-)
w 混合液的pH=7 a=b 混合液中c(B+)=c(A-)+c(OH-)
 混合液的pH = 7 混合液中,c ( B+)= c (A.- )+ c ( OH -) a = b
混合液的pH = 7 混合液中,c ( B+)= c (A.- )+ c ( OH -) a = b
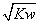 混合液的pH=7 a=b 混合液中,c(B+)=c(A-)+c(OH-)
混合液的pH=7 a=b 混合液中,c(B+)=c(A-)+c(OH-)
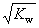 mol·L-1 混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-) 混合溶液的pH=7
mol·L-1 混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-) 混合溶液的pH=7
 混合溶液的pH=7 a=b 混合溶液中:c(B+)=c(A−)+c(OH−)
混合溶液的pH=7 a=b 混合溶液中:c(B+)=c(A−)+c(OH−)
 混合溶液的pH=7 a=b 混合溶液中:c(B+)=c(A−)+c(OH−)
混合溶液的pH=7 a=b 混合溶液中:c(B+)=c(A−)+c(OH−)
 混合液的pH=7 a=b 混合液中,c(B+)=c(A-)+c(OH-)
混合液的pH=7 a=b 混合液中,c(B+)=c(A-)+c(OH-)
 混合液的pH=7 a=b 混合液中,c(B+)=c(A-)+c(OH-)
混合液的pH=7 a=b 混合液中,c(B+)=c(A-)+c(OH-)
 w 混合液的pH=7 a=b 混合液中c(B+)=c(A-)+c(OH-)
w 混合液的pH=7 a=b 混合液中c(B+)=c(A-)+c(OH-)
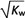 mol·L-1
mol·L-1
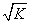 w 混合液的pH=7 a=b 混合液中c(B+)=c(A-)+c(OH-)
w 混合液的pH=7 a=b 混合液中c(B+)=c(A-)+c(OH-)
 mol·L-1 混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
mol·L-1 混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
 mol/L 向反应后的混合液中滴加石蕊试液后呈紫色
mol/L 向反应后的混合液中滴加石蕊试液后呈紫色