你可能感兴趣的试题
此反应有单质生成 该反应属于分解反应 可表示2H2+O2 2H2O 的反应 可表示CO2 +C.
2H2O 的反应 可表示CO2 +C.  2CO的反应
2CO的反应
反应过程中能量关系可用右图表示 ΔH.的值与反应方程式的化学计量数有关 若将该反应设计成原电池,则锌为负极 若将该反应设计为原电池,当有32.5 g锌溶解时, 正极放出气体一定为11.2L
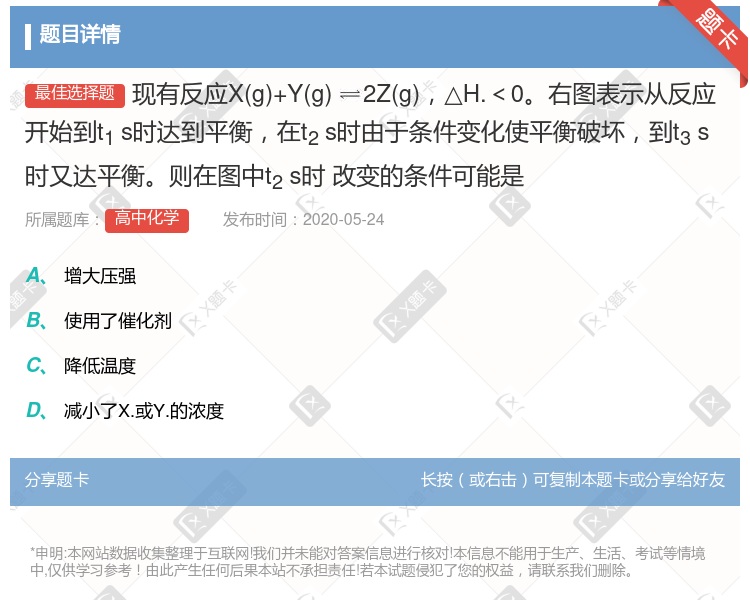
增大压强 使用了催化剂 降低温度 减小了X.或Y.的浓度
生石灰加水生成熟石灰 C.+H2O=CO+H2 金属钠与水反应 HNO3+NaOH=NaNO3+H2O
化学计量数a与b之和一定等于c与d之和 反应物A.和B.的质量比一定等于生成物 和 的质量比 C.若取zgA和zgB反应,生成C.和D.的质量总和不一定是2zg D.若A.和C.都是盐,则该反应一定是复分解反应
a+ba+b△H>0时,y轴表示达到平衡时B.的转化率 △H<0时,y轴表示达到平衡时A.的浓度 
正反应速率 平衡混合气体中NH3的含量 平衡混合气体中N2的物质的量 H2的转化率 
m+m<y ,△H.<0 m+m>y ,△H.>0 m+m<y ,△H.>0 m+m>y ,△H.<0
右图表明催化剂可以改变反应的热效应 右图表示某反应能量的变化与生成物状态无关 右图表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 右图表明化学反应不仅遵循质量守恒定律,也遵循能量守恒
反应过程中能量关系可用右图表示 若将该反应设计成原电池锌为负极 ΔH.的值与反应方程式的计量系数无关 若将其设计为原电池当有32.5g锌溶解时,正极放出气体一 定为11.2L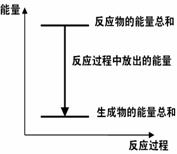
a+ba+b△H>0时,y轴表示达到平衡时B.的转化率 △H>0时,y轴表示达到平衡时A.的浓度 
Ⅰ图表示反应进行过程中气体平均相对分子质量的变化 Ⅱ图表示反应进行过程中气体密度的变化 Ⅲ图表示反应达到平衡后,移去一些焦炭后水蒸气的百分含量的变化(忽略表面积的影响) Ⅳ图表示反应达到平衡后,升高温度CO的百分含量的变化
置换反应 分解反应 化合反应 复分解反应 
(s)+B(g) nC(g);△H=QKJ/mol,在不同条件下反应混合物中C.的百分含量和反应过程所需时间的关系曲线。下列有关叙述中一定正确的  A.若条件为催化剂,则a表示有催化剂,b表示没有催化剂 只控制温度,则a比b的温度高,且△H>0 只控制压强,则a比b的压强大,n>2 由图象可以作出判断,反应一定从正反应方向开始
A.若条件为催化剂,则a表示有催化剂,b表示没有催化剂 只控制温度,则a比b的温度高,且△H>0 只控制压强,则a比b的压强大,n>2 由图象可以作出判断,反应一定从正反应方向开始
正反应速率 平衡混合气体中NH3的含量 平衡混合气体中N2的物质的量 H2的转化率 
生石灰加水生成熟石灰 C.+H2O=CO+H2 金属钠与水反应 HNO3+NaOH=NaNO3+H2O
反应过程中能量关系可用右图表示 ΔH.的值与反应方程式的计量系数有关 若将该反应设计成原电池锌为负极 若将其设计为原电池当有32.5g锌溶解时, 正极放出气体一定为11.2L
 2H2O 的反应 可表示CO2 +C.
2H2O 的反应 可表示CO2 +C.  2CO的反应
2CO的反应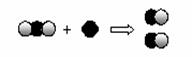







 A.若条件为催化剂,则a表示有催化剂,b表示没有催化剂 只控制温度,则a比b的温度高,且△H>0 只控制压强,则a比b的压强大,n>2 由图象可以作出判断,反应一定从正反应方向开始
A.若条件为催化剂,则a表示有催化剂,b表示没有催化剂 只控制温度,则a比b的温度高,且△H>0 只控制压强,则a比b的压强大,n>2 由图象可以作出判断,反应一定从正反应方向开始
