你可能感兴趣的试题
反应在t1min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1,反应在t1时未达平衡, 在t2时达到平衡 保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时, n(CO2)=0.40 mol。 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时 CO转化率增大,H2O的体积分数增大 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
反应在0~t1 min内的平均速率为v(SO3)=0.088/t1 mol·L-1·min-1 保持其他条件不变,起始时向容器中充入0.10molSO3和0.010 molO2,到达平衡时,n(SO2)=0.012 mol 保持其他条件不变,升高温度,平衡时c(SO2)=0.0070mol·L-1,则反应的△H.>0 相同温度下,起始时向容器中充入0.050molSO2和0.030molO2,达到平衡时SO2转化率小于88%
反应在前5min的平均速率为v (SO2)=0.08mol·L−1 ·min−1 保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,v (正)> v (逆) 该温度,反应的平衡常数为11.25L·mol-1 相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40%
反应在t1min内的平均速率为 保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时n(CO2)=0.4mol 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减少. 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时n(CO2)=0.4mol 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减少. 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
反应在t1min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1 保持其他条件不变,起始时向容器中充入0.60 molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol。 保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
反应在t1min内的平均速率为ν(H2)=0.40/t1 mol·L-1·min-1 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小 保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时n(CO2)=0.40mol 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
反应在前10 min内的平均速率为v(SO2)=0.06 mol·L-1·min-1 相同温度下,若起始时向容器中充入1.8 mol SO3(g),则达平衡时SO3(g)的转化率小于40% 保持其他条件不变,若起始时向容器中充入2 mol SO3(g),则达平衡时吸收的热量为78.4 kJ 相同温度下,若起始时向容器中充入0.40 mol SO2、0.20 mol O2和0.6 mol SO3(g),则反应达到平衡前有v(正)>v(逆)
恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,Ni(CO)4的百分含量将减小 在80 ℃时,测得某时刻Ni(CO)4、CO浓度均为0.5 mol·L-1,则此时v(正)恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动 上述生成Ni(CO)4(g)的反应为吸热反应
容器内的压强不发生变化说明该反应达到平衡 当向容器中再充入0.20 mol NO时,平衡向正反应方 向移动,K.增大 第12 min时改变的反应条件为升高温度 向该容器内充入He气,容器内气体压强增大,所以 反应速率增大
反应在t1min内的平均速率为 保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
反应在t1min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1 保持其他条件不变,起始时向容器中充入0.60 molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol。 保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
在t1min内平均速率为 保持其他条件不变,起始时向容器中充入0.60mol CO和1.20 mol H2O,到达平衡时n(CO2)=0.4mol 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
反应在t1min内的平均速率为v(H2)=0.40/t1 mol·L.-1·min-1 保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol。 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小。 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
反应在t1min内的平均速率为v(H2)=0.20/t1 mol·L-1·min-1 保持其他外界条件不变,若起始时向容器中充入1.20 mol CO和1.20 mol H2O,反应在t1min内的平均速率会增大 保持其他外界条件不变,按图表中的通入量,初始再多通入0.20mol氦气,则反应在t1min内的平均速率会增大 在t1到 t2时间段内,上述可逆反应已经达到平衡状态
恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,Ni(CO)4的百分含量将增大 在80 ℃时,测得某时刻Ni(CO)4、CO浓度均为0.5 mol·L-1,则此时v(正)恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动 上述生成Ni(CO)4(g)的反应为吸热反应
用H2表示反应在t1 min内的平均速率为v(H2)=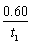 mol·L−1·min−1 保持其他条件不变,t1时向容器中充入3.00 mol N2,达到平衡时,n(CO2)=1.20 mol 保持其他条件不变,在t2 min时向容器中再通入1.00 mol CO,与原平衡相比,达到新平衡时CO的转化率将增大 温度升至T.2K.,上述反应的平衡常数为0.70,则正反应的ΔH.<0
mol·L−1·min−1 保持其他条件不变,t1时向容器中充入3.00 mol N2,达到平衡时,n(CO2)=1.20 mol 保持其他条件不变,在t2 min时向容器中再通入1.00 mol CO,与原平衡相比,达到新平衡时CO的转化率将增大 温度升至T.2K.,上述反应的平衡常数为0.70,则正反应的ΔH.<0
B.装入容积为1L.的恒温密闭容器中,发生反应:2A(g)+bB(g)  cC.(g),1 min时达到平衡,C.的浓度为x mol·L-1。若保持温度不变,将密闭容器的容积压缩为原来的
cC.(g),1 min时达到平衡,C.的浓度为x mol·L-1。若保持温度不变,将密闭容器的容积压缩为原来的 ,重新达到平衡后,C.的浓度为2.5 x mol·L-1,下列说法正确的是: ( ) A.化学计量数的关系:b容器的容积减小后,该反应的逆反应速率减小 原容器中用B.浓度变化表示该反应在1 min内的速率为
,重新达到平衡后,C.的浓度为2.5 x mol·L-1,下列说法正确的是: ( ) A.化学计量数的关系:b容器的容积减小后,该反应的逆反应速率减小 原容器中用B.浓度变化表示该反应在1 min内的速率为 mol·(L·min)-1 若保持温度和容器容积不变,充入氦气(不参与反应),平衡不发生移动
mol·(L·min)-1 若保持温度和容器容积不变,充入氦气(不参与反应),平衡不发生移动

 保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时n(CO2)=0.4mol 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减少. 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时n(CO2)=0.4mol 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减少. 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
 保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
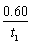 mol·L−1·min−1 保持其他条件不变,t1时向容器中充入3.00 mol N2,达到平衡时,n(CO2)=1.20 mol 保持其他条件不变,在t2 min时向容器中再通入1.00 mol CO,与原平衡相比,达到新平衡时CO的转化率将增大 温度升至T.2K.,上述反应的平衡常数为0.70,则正反应的ΔH.<0
mol·L−1·min−1 保持其他条件不变,t1时向容器中充入3.00 mol N2,达到平衡时,n(CO2)=1.20 mol 保持其他条件不变,在t2 min时向容器中再通入1.00 mol CO,与原平衡相比,达到新平衡时CO的转化率将增大 温度升至T.2K.,上述反应的平衡常数为0.70,则正反应的ΔH.<0
 cC.(g),1 min时达到平衡,C.的浓度为x mol·L-1。若保持温度不变,将密闭容器的容积压缩为原来的
cC.(g),1 min时达到平衡,C.的浓度为x mol·L-1。若保持温度不变,将密闭容器的容积压缩为原来的 ,重新达到平衡后,C.的浓度为2.5 x mol·L-1,下列说法正确的是: ( ) A.化学计量数的关系:b
,重新达到平衡后,C.的浓度为2.5 x mol·L-1,下列说法正确的是: ( ) A.化学计量数的关系:b mol·(L·min)-1 若保持温度和容器容积不变,充入氦气(不参与反应),平衡不发生移动
mol·(L·min)-1 若保持温度和容器容积不变,充入氦气(不参与反应),平衡不发生移动