

 2Z(g) 保持其他条件不变,升高温度,反应的化学平衡常数K.减小 若改变反应条件,使反应进程如图 (3)所示,则改变的条件是增大压强
2Z(g) 保持其他条件不变,升高温度,反应的化学平衡常数K.减小 若改变反应条件,使反应进程如图 (3)所示,则改变的条件是增大压强
 2Z(g) 保持其他条件不变,升高温度,反应的化学平衡常数K.减小 若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
2Z(g) 保持其他条件不变,升高温度,反应的化学平衡常数K.减小 若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
 2Z(g)
2Z(g)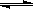 2Z(g)
2Z(g) 2Z(g) 保持其他条件不变,升高温度,反应的化学平衡常数K.减小 若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
2Z(g) 保持其他条件不变,升高温度,反应的化学平衡常数K.减小 若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强

 2Z(g) 保持其他条件不变,升高温度,反应的化学平衡常数K.减小 反应进行的前3 min内,用X.表示的反应速率 v(X)=0.2mol·(L·min) −1 若改变反应条件,使反应进程如图3所示,则改变的条件是使用催化剂
2Z(g) 保持其他条件不变,升高温度,反应的化学平衡常数K.减小 反应进行的前3 min内,用X.表示的反应速率 v(X)=0.2mol·(L·min) −1 若改变反应条件,使反应进程如图3所示,则改变的条件是使用催化剂
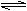
 2Z(g) 保持其他条件不变,升高温度,化学平衡向逆反应方向移动 反应进行前4 min内,用X.表示的反应速率 v(X)=0.075mol•(L•min) -1 若改变反应条件,使反应进程如图3所示,则改变的条件是使用催化剂
2Z(g) 保持其他条件不变,升高温度,化学平衡向逆反应方向移动 反应进行前4 min内,用X.表示的反应速率 v(X)=0.075mol•(L•min) -1 若改变反应条件,使反应进程如图3所示,则改变的条件是使用催化剂
 2Z(g) 保持其他条件不变,升高温度,反应的化学平衡常数K.减小 若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
2Z(g) 保持其他条件不变,升高温度,反应的化学平衡常数K.减小 若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强