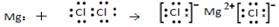你可能感兴趣的试题
核外电子数为奇数的基态原子,其原子轨道中一定含有“未成对电子” 核外电子数为偶数的基态原子,其原子轨道中一定不含“未成对电子” 核外电子数为偶数的基态原子,其原子轨道中可能含有“未成对电子” 核外电子数为奇数的基态原子,其原子轨道中可能不含“未成对电子”
C2 H4分子比例模型:  N2的结构式: :N≡N: 基态氮原子L.层电子的轨道表示式:
N2的结构式: :N≡N: 基态氮原子L.层电子的轨道表示式: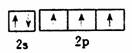 基态溴原子的核外电子排布式:4s24p5
基态溴原子的核外电子排布式:4s24p5
处于最低能量状态的原子叫做基态原子
3p2表示3p能级有两个轨道
同一原子中,1s、2s、3s轨道的能量逐渐减小
同一原子中,2p、3p、4p能级的轨道数依次增多
原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质 相似 Fe3+的最外层电子排布式为:3s23p63d5 基态铜原子的轨道表示式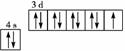 基态碳原子的轨道表示式
基态碳原子的轨道表示式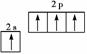
电子云是笼罩在原子核外的云雾 下列电子排布式:1s22s12p1 是某原子基态的排布式 任何能层中的d能级的轨道数都为5 [Ar]3d64s2表示的是Fe原子的电子排布式
处于最低能量的原子叫做基态原子 原子由基态变为激发态要产生发射光谱 同一原子中,2p能级比3p能级的轨道数少 3d轨道能量小于4s
A.B原子基态时核外电子排布式分别为1s22s2、1s2  A.B的结构示意图分別为 A.原子基态时2P轨道上有1个未成对电子,B原子基态时3p轨进上也有1个未成对电子 A原子基态时2P轨道上有一对成对电子,B原子基态时3p轨道上也有—对成对电子
A.B的结构示意图分別为 A.原子基态时2P轨道上有1个未成对电子,B原子基态时3p轨进上也有1个未成对电子 A原子基态时2P轨道上有一对成对电子,B原子基态时3p轨道上也有—对成对电子
HCl的电子式为 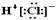 N2的结构式 N.≡N. O.原子处于基态的轨道表示式:
N2的结构式 N.≡N. O.原子处于基态的轨道表示式:  用电子式表示MgCl2的形成:
用电子式表示MgCl2的形成: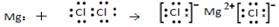
电子在各个轨道上具有的能量是连续的 原子能级,以电子伏特表示 合力与原子序数有关 移走轨道电子所需的最小能量叫结合能 原子处于能量最低状态时叫基态
电子在各个轨道上具有的能量是连续的 原子能级,以电子伏特表示 结合力与原子序数有关 移走轨道电子所需的最小能量叫结合能 原子处于能量最低状态时叫基态
处于最低能量状态的原子叫做基态原子 3p2表示3p能级有两个轨道
同一原子中,1s、2s、3s轨道的能量逐渐减小 同一原子中,2p、3p、4p能级的轨道数依次增多
电子在各个轨道上具有的能量是连续的 原子能级,以电子伏特表示 结合力与原子序数有关 移走轨道电子所需的最小能量称结合能 原子处于能量最低状态时称基态
基态时相同周期的两种元素的原子所占用的能级和能层是一样的 基态时稀有气体元素原子的价层电子数都为8 基态时同种元素的原子和离子的轨道排布式一样 非金属元素原子的d轨道一定不填充电子或填满电子

 N2的结构式: :N≡N: 基态氮原子L.层电子的轨道表示式:
N2的结构式: :N≡N: 基态氮原子L.层电子的轨道表示式: 基态溴原子的核外电子排布式:4s24p5
基态溴原子的核外电子排布式:4s24p5
 基态碳原子的轨道表示式
基态碳原子的轨道表示式
 A.B的结构示意图分別为 A.原子基态时2P轨道上有1个未成对电子,B原子基态时3p轨进上也有1个未成对电子 A原子基态时2P轨道上有一对成对电子,B原子基态时3p轨道上也有—对成对电子
A.B的结构示意图分別为 A.原子基态时2P轨道上有1个未成对电子,B原子基态时3p轨进上也有1个未成对电子 A原子基态时2P轨道上有一对成对电子,B原子基态时3p轨道上也有—对成对电子
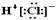 N2的结构式 N.≡N. O.原子处于基态的轨道表示式:
N2的结构式 N.≡N. O.原子处于基态的轨道表示式:  用电子式表示MgCl2的形成:
用电子式表示MgCl2的形成: