你可能感兴趣的试题
①式表示负极反应,②式表示正极反应 铅蓄电池的电解质溶液是硫酸溶液,在放电过程中,它的浓度逐渐降低 铅蓄电池在放电时,电子从Pb通过导线流向PbO2 铅蓄电池在充电时,原来负极发生的反应是:Pb+SO42―–2e―=PbSO4
工业用电解熔融AlCl3的方法制金属铝 铅蓄电池工作时,正极反应为: PbO2 + 2e- + 4H+ + SO42- = PbSO4 + 2H2O 电解饱和食盐水时,用铁作阳极,Cl- 发生氧化反应 电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属
PbO2是电池的负极 负极的电极反应式为:Pb(s)+SO42(aq)–2e – = PbSO4(s) 铅蓄电池属于一次电池 电池放电时,溶液酸性增强
在放电时,正极发生的反应是Pb(s)+SO (aq) -2e-=PbSO4(s) 在放电时,该电池的负极材料是铅板 在充电时,电池中硫酸的浓度不断变小 在充电时,阳极发生的反应是PbSO4(s)+2e-=Pb(s)+SO
(aq) -2e-=PbSO4(s) 在放电时,该电池的负极材料是铅板 在充电时,电池中硫酸的浓度不断变小 在充电时,阳极发生的反应是PbSO4(s)+2e-=Pb(s)+SO (aq)
(aq)
放电时,正极发生的反应是Pb+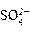 -2e- = PbSO4 充电时,每消耗1 mol PbSO4的同时转移2 mol电子 放电时,该电池的负极材料是铅板 充电时,电池中硫酸的浓度不断变小
-2e- = PbSO4 充电时,每消耗1 mol PbSO4的同时转移2 mol电子 放电时,该电池的负极材料是铅板 充电时,电池中硫酸的浓度不断变小
PbO2是电池的负极 负极的电极反应式为:Pb(s)+SO42-(aq)–2e – = PbSO4(s) 铅蓄电池属于一次性电池 电池放电时,溶液酸性增强
放电时正极PbO2和负极Pb均生成PbSO4,并且电解液相对密度变小; 充电时PbSO4正极转变为PbO2,负极转变为Pb,并且电解液相对密度变小; 充电时PbSO4正极转变为Pb,负极转变为PbO2,并且电解液相对密度变小 放电时负极PbO2和正极Pb均生成PbSO4,并且电解液相对密度变小;
充电时正极的电极反应式:PbSO4+2H2O-2e-===PbO2+4H++SO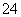 当电路中转移0.2 mol电子时,电池中消耗的H2SO4为0.2 mol 铅蓄电池充电时SO
当电路中转移0.2 mol电子时,电池中消耗的H2SO4为0.2 mol 铅蓄电池充电时SO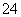 向Pb电极迁移 铅蓄电池充电时,铅电极应接外加电源的负极
向Pb电极迁移 铅蓄电池充电时,铅电极应接外加电源的负极
PbO2 /Pb PbO2 /PbO2 PbO2/PbSO4 PbSO4/PbSO4
放电时:当外电路通过1mol的电子时,理论上负极板的质世增加了151.5g 充电时:阳极反应是PbSO4→2e-+2 H2O =PbO2+ SO42-+4H+ 放电时:正极反应是Pb-2e-+ SO42-= PbSO4 充电时:铅蓄电池的阴极应与电源的正极相连
Pb为正极,PbO2为负极 正极电极反应式为PbO2 + SO4 2- + 2H+ == PbSO4 + H2O 硫酸溶液中,H+移向负极 放电一段时间后,SO4 2-浓度减小
放电时Pb为负极 充电时阳极的电极反应式:PbSO4+2H2O-2e-=PbO2+4H++SO42- 放电完全后铅蓄电池可进行充电,此时铅蓄电池的负极连接外电源的正极 用铅蓄电池电解CuCl2溶液,若制得2.24L Cl2(标准状况),这时电池内至少转移 0.2 mol电子
0.050mol 0.075mol 0.20mol 0.40mol
H2SO4浓度上升 正极上的PbSO4减少 内阻减小 电解液密度下降

 (aq) -2e-=PbSO4(s) 在放电时,该电池的负极材料是铅板 在充电时,电池中硫酸的浓度不断变小 在充电时,阳极发生的反应是PbSO4(s)+2e-=Pb(s)+SO
(aq) -2e-=PbSO4(s) 在放电时,该电池的负极材料是铅板 在充电时,电池中硫酸的浓度不断变小 在充电时,阳极发生的反应是PbSO4(s)+2e-=Pb(s)+SO (aq)
(aq)
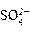 -2e- = PbSO4 充电时,每消耗1 mol PbSO4的同时转移2 mol电子 放电时,该电池的负极材料是铅板 充电时,电池中硫酸的浓度不断变小
-2e- = PbSO4 充电时,每消耗1 mol PbSO4的同时转移2 mol电子 放电时,该电池的负极材料是铅板 充电时,电池中硫酸的浓度不断变小
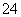 当电路中转移0.2 mol电子时,电池中消耗的H2SO4为0.2 mol 铅蓄电池充电时SO
当电路中转移0.2 mol电子时,电池中消耗的H2SO4为0.2 mol 铅蓄电池充电时SO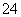 向Pb电极迁移 铅蓄电池充电时,铅电极应接外加电源的负极
向Pb电极迁移 铅蓄电池充电时,铅电极应接外加电源的负极