你可能感兴趣的试题
铁片上发生氧化反应Fe 3e- == Fe3+ 铜片上发生还原反应 2H++2e- =H2 铜片上发生氧化反应 Cu2e- == Cu2+ 溶液中NO3-的浓度基本不变
当1 mol Cu(IO3)2发生反应共转移的电子为10mol 反应中KI被氧化 I2是氧化产物CuI是还原产物 当1 mol Cu(IO3)2发生反应被Cu2+氧化的I.—为2 mol
H2O2→H2O Cu → Cu2+ HCl →H2 Cu2+→Cu
石墨棒 石墨棒 CuSO4溶液 Cu 石墨棒 Na2SO4溶液 Cu Fe H2SO4溶液 Cu Pt H2O
用铜片作阴、阳电极,电解氯化铜溶液 用铜片作阴、阳电极,电解硫酸钾溶液 铜锌合金在潮湿空气发生电化学腐蚀 铜片作原电池的负极,碳棒作原电池的正极,氯化钠作电解质溶液
钛电极发生氧化反应 阳极附近溶液的pH逐渐增大 离子交换膜应采用阳离子交换膜 阳极反应式是:2Cu+2OH--2e-===Cu2O+H2O
铜片作原电池的负极,碳棒作原电池的正极,氯化钠作电解质溶液 铜锌合金在潮湿的空气中发生电化学腐蚀 用铜片作阴、阳电极,电解稀硫酸 用铜片作阳极,铁作阴极,电解硫酸钠溶液
Cu+H2SO4==CuSO4+H2↑ Zn+2HCl==ZnCl2+H2↑ Cu+2AgNO3==Cu(NO3)2+2Ag 2Al+3CuSO4==3Cu+Al2(SO4)3
钛电极发生氧化反应 阳极附近溶液的pH逐渐增大 离子交换膜应采用阳离子交换膜 阳极反应式是:2Cu+2OH--2e-===Cu2O+H2O
2H++2e-=H2↑ Fe2++2e-=Fe
Cu2++2e-=Cu 2H2O+O2+4e-=4OH-
铜片作原电池的负极,碳棒作原电池的正极,氯化钠作电解质溶液 铜锌合金在潮湿空气中发生电化学腐蚀 用铜片作阴、阳电极,电解硫酸钠溶液 用铜片作阴、阳电极,电解硫酸铜溶液
钛电极发生氧化反应 阳极附近溶液的pH逐渐增大 离子交换膜应采用阳离子离子交换膜 阳极反应式是:2Cu+2OH一一2e一== Cu2O+H2O 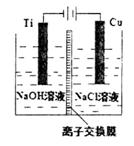
Cu+H2SO4===CuSO4+H2↑ Fe+Zn(NO3)2===Fe(NO3)2+Zn CuCl2+2NaOH===Cu(OH)2↓+2NaCl Na2CO3+2KNO3===K2CO3+2NaNO3

