你可能感兴趣的试题
有三支试管出现沉淀时,则A是AgNO3溶液 若全部没有什么现象变化时,则A是NH4NO3溶液 一支试管出现气体,两支试管出现沉淀时,则A是HCl溶液 若只有两支试管出现沉淀时,则A是BaCl2溶液
若有三支试管出现沉淀时,则后加入的是AgNO3溶液 全都没有明显现象时,则后加入的是NH4NO3溶液 一支试管出现气泡,两支试管出现沉淀时,则后加入的是HCl溶液 若只有两支试管出现沉淀时,则后加入的是BaCl2溶液
放热反应不需要加热就能发生 升高温度或加入催化剂,均可以改变化学反应的反应热 同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH.不同 一定条件下某吸热反应能自发进行,说明该反应是熵增大的反应
H(g) + Cl(g) = HCl(g) ΔH=﹣431 kJ·mol-1 2HCl(g) = H2(g) + Cl2(g)的反应热ΔH<0 H2(g) + Cl2(g) = 2HCl(g) ΔH=﹣183 kJ 相同条件下,H2(g)+ Cl2(g) =2HCl(g)反应在光照和点燃条件下的ΔH不相等
在过氧化氢酶的作用下,过氧化氢分解最快,是因为20%的肝脏研磨液的浓度高于3.5%的FeC13溶液 3.5%FeC13对过氧化氢分解速率慢是因为其分子摩尔浓度过高,影响了活性的正常发挥 肝脏研磨液中过氧化氢分解速率快,是因为酶的催化效率比一般无机催化剂催化效率高 如果将四支试管放在90℃水浴中,第4支试管(加肝脏研磨液的试管)反应速度仍为最快
需要加热的化学反应,生成物的总能量一定高于反应物的总能量 同温同压下,反应H2 (g)+Cl2 (g) = 2HCl (g) 在光照和点燃条件下的ΔH.不同 升高温度或加入催化剂,可以改变化学反应的反应热 相同条件下,等量的硫蒸气和硫固体分别完全燃烧,后者放出的热量少
自发反应在任何条件下都能实现 1/2 molH2SO4和1/2 molBa(OH)2完全中和所放出的热量为中和热 同温同压下,H2(g)+ Cl2(g)==2HCl(g)在光照和点燃条件下的ΔH不同 熵增加的放热反应一定条件下能自发进行
该反应的反应热 D.H. > 0 氢气分子中的化学键比氯气分子中的化学键更稳定 相同条件下,该反应在光照和点燃条件下的 H.不同 D.H2与Cl2反应的热化学方程式为 H2(g) +Cl2(g) = 2HCl(g) D.H = -183 kJ
2HCl(g)=H2(g)+Cl2(g)的反应热ΔH<0 H(g)+Cl(g)=HCl(g)ΔH.=+431kJmol-1 相同条件下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH.相等 H2 (g)+Cl2(g)=2HCl(g)ΔH.=-183kJ
H.﹣H.键比Cl﹣Cl键稳定 △H=﹣184.5 kJ•mol﹣1 正反应活化能比逆反应活化能高 在相同条件下,1mol H2(g)和1mol Cl2(g)分别在点燃和光照条件下反应生成2mol HCl(g),重新恢复到原来的状态时△H相同
①>②>③>④ ②>③>④>① ①=②=③=④ ③>②>①>④
等质量的硫蒸气和硫固体分别完全燃烧,相同条件下,前者放出的热量多 可逆反应达到平衡,反应就不再进行 加入催化剂加快了反应速率,改变了反应吸收或放出的热量 同温、同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH.不同
强酸与强碱反应都是放热反应 氧化还原反应一定都是放热反应 放热反应的反应速率总是大于吸热反应的反应速率 同温同压下,反应H2(g)+Cl2(g)  2HCl(g)在光照和点燃条件下的
2HCl(g)在光照和点燃条件下的 不同
不同
该反应的反应热△H>0 生成1mol HCl时反应放热431kJ 氢气分子中的化学键比氯气分子中的化学键更稳定 相同条件下,氢气分子具有的能量高于氯气分子具有的能量
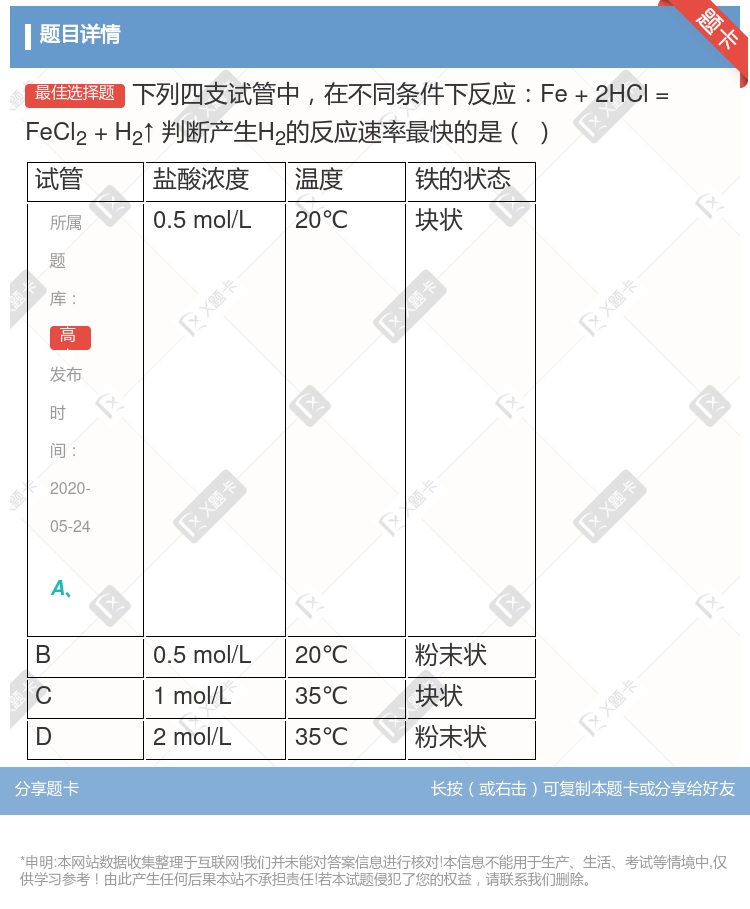
 2HCl(g)在光照和点燃条件下的
2HCl(g)在光照和点燃条件下的 不同
不同