你可能感兴趣的试题
实验室制取CO2或O2可选用Ⅱ、Ⅳ装置 实验室用锌粒和稀硫酸制取H2可选用Ⅱ、Ⅳ装置 用氯酸钾制取干燥的氧气可选用Ⅰ、Ⅴ装置,且氧气从b端进入 装置Ⅲ与Ⅱ相比,其优点是能控制反应的速率
镁为负极 原电池中碳极的电极反应式为 电解池中阳极处先变红 电解池中阴极的电极反应式为
电解池中阳极处先变红 电解池中阴极的电极反应式为

d为石墨,铁片腐蚀加快 d为石墨,石墨上电极反应为2H++2e-=H2↑ d为锌块,铁片不易被腐蚀 d为锌块,铁片上电极反应为2Cl--2e-=Cl2↑
电化学腐蚀原理是电池作用原理 有电位不同的两个极 两极在同一电解质溶液中 在阴极发生氧化反应,在阳极发生还原反应
d为石墨,铁片腐蚀加快 d为石墨,石墨上电极反应为:O2+2H2O+4e-===4OH- d为锌块,铁片不易被腐蚀 d为锌块,铁片上电极反应为:2H++2e-===H2↑
电子移动:电极Ⅰ→电极Ⅳ→电极Ⅲ→电极Ⅱ 电极Ⅰ发生还原反应 电极Ⅳ逐渐溶解 电极Ⅲ的电极反应:Cu-2e-=Cu2+
电流方向:电极Ⅳ→A→电极Ⅰ 电极Ⅰ发生还原反应 电极Ⅱ逐渐溶解 电极Ⅲ的电极反应:Cu2++2e-===Cu
甲装置是电解池,乙装置是原电池 当甲中产生0.1 mol气体时,乙中析出固体的质量为6.4 g 实验一段时间后,甲烧杯中溶液的pH减小 将乙中的C.电极换成铜电极,则乙装置可变成电镀装置
d为石墨,铁片腐蚀加快 d为石墨,石墨上电极反应为2H++2e-=H2↑ d为锌块,铁片不易被腐蚀 d为锌块,铁片上电极反应为2Cl--2e-=Cl2↑
过滤得到的沉淀可能是FeS 与a极相连的电极反应式为2Cl--2e-=Cl2 可以用Fe与外接电源的a极相连 电解后的滤液可以循环利用
过滤得到的沉淀可能是FeS 与a极相连的电极反应式为2Cl--2e-=Cl2 可以用Fe与外接电源的a极相连 电解后的滤液可以循环利用
具有可见的阴阳极 阳极不断溶解 阳极发生氧化反应 由金属表面的电化学不均匀性引起的
d为石墨,铁片腐蚀加快 d为石墨,石墨上电极反应为:O2+2H2O+4e ═ 4OH- d为锌块,铁片不易被腐蚀 d为锌块,铁片上电极反应为:2H++2e ═ H2↑
上述实验中已明显发生电化学腐蚀的实验是3、4、5、6 影响金属腐蚀的外部因素有湿度、温度、O2的浓度、电解质等 实验6中铁被腐蚀的程度比5严重是因铁发生了如下反应:Fe-2e-===Fe2+ 若保持铁表面干燥或将锌与铁相连,可起到保护铁制品的作用
d为石墨,铁片腐蚀加快 d为石墨,石墨上电极反应为:O2+2H2O+4e﹣→4OH﹣ d为锌块,铁片不易被腐蚀 d为锌块,铁片上电极反应为:2H++2e﹣→H2↑
d为石墨,铁片腐蚀加快 d为石墨,石墨上电极反应为:O2+2H2O+4e-===4OH- d为锌块,铁片不易被腐蚀 d为锌块,铁片上电极反应为:2H++2e-===H2↑
由可见电极的宏观电池引起的 电化学腐蚀将使电位高的金属不断被腐蚀的 由同一金属不同部位在不同浓度的电解液中引起的 由不同电位的金属在电解液中接触引起的
电子移动:电极Ⅰ→电极Ⅳ→电极Ⅲ→电极Ⅱ 电极Ⅰ发生还原反应 电极Ⅳ逐渐溶解 电极Ⅲ的电极反应:Cu-2e-===Cu2+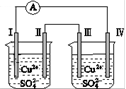
由可见电极的宏观电池引起的 电化学腐蚀过程中不产生电流 电化学腐蚀将使阳极金属不断被腐蚀 电化学腐蚀分别在阴阳极发生还原和氧化反应
电子移动:电极Ⅰ→电极Ⅳ→电极Ⅲ→电极Ⅱ 电极Ⅰ发生还原反应 电极Ⅳ逐渐溶解 电极Ⅲ的电极反应:Cu-2e-===Cu2+

 电解池中阳极处先变红 电解池中阴极的电极反应式为
电解池中阳极处先变红 电解池中阴极的电极反应式为

