你可能感兴趣的试题
稀硫酸中:K+、Mg2+、A.1O2-、S2O32- NaHS 溶液中:SO42-、K+、 1-、Cu2+ C.KW/c(H+)=10-13 mol·L-1 的溶液中:Fe3+、NH4+、Mg2+、SO42- 通人大量 CO2 的溶液中:Na+、ClO-、CH3COO-、HCO3-
在PH=1的溶液中:NaCl、Na2CO3、Na2SO4 在PH=2的溶液中:KCl、 Na2SO4 HNO3 在PH=13的溶液中:BaCl2、Na2CO3、NaOH 在PH=14的溶液中:Fe Cl3、Ba(NO3)2、CaCl2
室温下,CH3COOH分子可能存在于pH=8的碱性溶液中 在0.1mol・L-1的氢溴酸中加入适量的蒸馏水,溶液的c(H+)减少 在c(H+)=c(OH-)的溶液中,AlO2-不可能大量存在 由水电离出的c(OH-)=1×10-12mol・L-1的溶液中,Al3+不可能大量存在
甲、乙两溶液的pH不可能相同 甲、乙两种溶液中加入Al粉都会产生H2 HCO 不可能在甲、乙两溶液中大量共存 甲不可能是盐溶液,乙不可能是酸或碱溶液
不可能在甲、乙两溶液中大量共存 甲不可能是盐溶液,乙不可能是酸或碱溶液
室温下,HClO分子不可能存在于pH>7的溶液中; 在[OH-]=[H+]的溶液中,AlO2-不可能大量存在; 在NaAlO2溶液中,HCO3-不可能大量存在; 在水溶液中石炭酸比碳酸容易电离。
室温下,乙酸分子可以存在于pH=8的碱性溶液中 在0.1mol・L-1氢溴酸中加入适量的蒸馏水,溶液中氢离子的浓度减小 在水电离出c(OH-)=1×10-12mol・L-1的溶液中,Al3+不可能大量存在 AlCl3在溶液中,HCO3-不可能大量存在
Fe3+、Ba2+、NO3-、Na+ K+、SO42-、CO32-、Cl- K+、Na+、Ba2+、OH- OH-、Na+、Cl-、Ca2+
纯碱溶液中:Al3+、Ba2+、Cl-、NO3- 室温下,pH=1的溶液中:K+、Fe2+、MnO4-、I- 能使甲基橙变为黄色的溶液中:Na+、Al3+、Cl- 室温下, =1×10-12的溶液中:K+、Na+、CO3-、NO3-
=1×10-12的溶液中:K+、Na+、CO3-、NO3-
在Na【Al(OH)4】溶液中,Al3+可能大量存在 向Ca(ClO)2溶液中通入二氧化硫,反应的离子方程式为: Ca2+ + 2ClO- + H2O + SO2 ═CaSO3↓+ 2HClO 在由水电离出的c(OH-)=1×10-12mol·L-1的溶液中,Al3+不可能大量存在 室温下pH=6的酸性溶液中,可能存在NH3·H2O分子
pH=1的溶液中:Na+、Cl-、K.+、CH3COO- 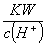 =0.1 mol·L-1的溶液:Na+、K.+、AlO2-、NO3- 加入KSCN溶液变红色的溶液中:HCO3-、Ba2+ 、NO3-、Na+ 由水电离出c(OH-)=1×10-12 mol·L-1的溶液中:K.+、HSO3-、Na+、Cl-
=0.1 mol·L-1的溶液:Na+、K.+、AlO2-、NO3- 加入KSCN溶液变红色的溶液中:HCO3-、Ba2+ 、NO3-、Na+ 由水电离出c(OH-)=1×10-12 mol·L-1的溶液中:K.+、HSO3-、Na+、Cl-
甲、乙两溶液的pH不可能相同 甲、乙两种溶液中加入Al粉都会产生H2 HCO 不可能在甲、乙两溶液中大量共存 甲不可能是盐溶液,乙不可能是酸或碱溶液
不可能在甲、乙两溶液中大量共存 甲不可能是盐溶液,乙不可能是酸或碱溶液
pH=1的溶液中:Na+、Fe3+、NO3﹣、I.﹣ 水电离出的c(H+)= 1×10﹣12mol·L.﹣1的溶液中:K+、Al3+、Cl﹣、SO42﹣ c( Al 3+)= 0.1 mol·L.﹣1的溶液中:Na+、K+、HCO3﹣、Cl﹣ 加入KSCN溶液显红色的溶液:K+、NH4+、Cl﹣、NO3﹣
饱和氯水中: c(H-)=1.0×10-13mol·L-1溶液中:
c(H-)=1.0×10-13mol·L-1溶液中: Na2S溶液中:
Na2S溶液中: pH=12的溶液中:
pH=12的溶液中:
含有大量NO—2的水溶液中:Na+、Fe2+、SO2-4、H+ 在pH=12的溶液中:ClO—、S2-、Na+、K+ 能使pH试纸变蓝的溶液 NH4+ Na+ SO42- Fe3+ 含有大量HCO—3的澄清透明溶液中:K+、C6H5O—、Cl—、CH3COO—
K.+、C.1一、SO42一、Na + K+、SO42一、CO32一、Cl一 K+、 Na+、Ba2+、NO3一 H +、CO32一、C.1一、Ca2+
室温下,HClO分子不可能存在于c(OH-)>c(H+)的溶液中 室温下,在pH=7的溶液中,CH3COO-不可能大量存在 漂白粉只有在酸的存在下生成次氯酸才具有漂白作用 c(CH3COO-)=c(Na+)的CH3COOH和CH3COONa的混合溶液呈中性

 不可能在甲、乙两溶液中大量共存 甲不可能是盐溶液,乙不可能是酸或碱溶液
不可能在甲、乙两溶液中大量共存 甲不可能是盐溶液,乙不可能是酸或碱溶液
 =1×10-12的溶液中:K+、Na+、CO3-、NO3-
=1×10-12的溶液中:K+、Na+、CO3-、NO3-
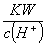 =0.1 mol·L-1的溶液:Na+、K.+、AlO2-、NO3- 加入KSCN溶液变红色的溶液中:HCO3-、Ba2+ 、NO3-、Na+ 由水电离出c(OH-)=1×10-12 mol·L-1的溶液中:K.+、HSO3-、Na+、Cl-
=0.1 mol·L-1的溶液:Na+、K.+、AlO2-、NO3- 加入KSCN溶液变红色的溶液中:HCO3-、Ba2+ 、NO3-、Na+ 由水电离出c(OH-)=1×10-12 mol·L-1的溶液中:K.+、HSO3-、Na+、Cl-
 不可能在甲、乙两溶液中大量共存 甲不可能是盐溶液,乙不可能是酸或碱溶液
不可能在甲、乙两溶液中大量共存 甲不可能是盐溶液,乙不可能是酸或碱溶液
 c(H-)=1.0×10-13mol·L-1溶液中:
c(H-)=1.0×10-13mol·L-1溶液中: Na2S溶液中:
Na2S溶液中: pH=12的溶液中:
pH=12的溶液中: