
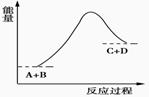
 A.该反应是放热反应 只有在加热条件下才能进行 反应物的总能量高于生成物的总能量 反应中断开化学键吸收的总能量高于形成化学键放出的总能量
A.该反应是放热反应 只有在加热条件下才能进行 反应物的总能量高于生成物的总能量 反应中断开化学键吸收的总能量高于形成化学键放出的总能量
 A.该反应为放热反应 B.该反应为吸热反应 C.反应物的总能量高于生成物的总能量 D.该反应只有在加热条件下才能进行
A.该反应为放热反应 B.该反应为吸热反应 C.反应物的总能量高于生成物的总能量 D.该反应只有在加热条件下才能进行
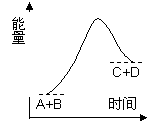 A. 该反应为吸热反应 该反应只有在加热条件下才能进行 反应物的总能量高于产物的总能量 形成产物C.和D.的化学键所放出的总能量高于断开反应物A.和B.的化学键所吸收的总能量
A. 该反应为吸热反应 该反应只有在加热条件下才能进行 反应物的总能量高于产物的总能量 形成产物C.和D.的化学键所放出的总能量高于断开反应物A.和B.的化学键所吸收的总能量
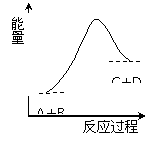 A.该反应为放热反应 B.该反应为吸热反应 C.反应物的总能量高于生成物的总能量 D.该反应只有在加热条件下才能进行
A.该反应为放热反应 B.该反应为吸热反应 C.反应物的总能量高于生成物的总能量 D.该反应只有在加热条件下才能进行
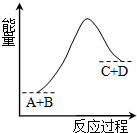
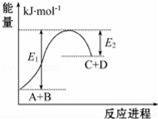
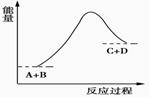 A.该反应是放热反应 只有在加热条件下才能进行 反应物的总能量高于生成物的总能量 反应中断开化学键吸收的总能量高于形成化学键放出的总能量
A.该反应是放热反应 只有在加热条件下才能进行 反应物的总能量高于生成物的总能量 反应中断开化学键吸收的总能量高于形成化学键放出的总能量
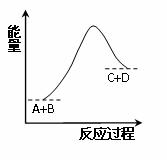

 A.该反应为放热反应 该反应为吸热反应 反应物的总能量低于生成物的总能量 该反应只有在加热条件下才能进行
A.该反应为放热反应 该反应为吸热反应 反应物的总能量低于生成物的总能量 该反应只有在加热条件下才能进行

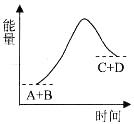
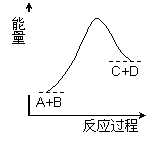
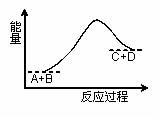
 A.该反应为吸热反应 B.该反应为放热反应 C.反应物的总能量高于生成物的总能量 D.该反应只有在加热条件下才能进行
A.该反应为吸热反应 B.该反应为放热反应 C.反应物的总能量高于生成物的总能量 D.该反应只有在加热条件下才能进行