
 0.1mol·L-1的NaHCO3溶液中:
0.1mol·L-1的NaHCO3溶液中: 将0.2mol·L-1NaA溶液和0.1mol·L-1盐酸等体积混合所得碱性溶液中:
将0.2mol·L-1NaA溶液和0.1mol·L-1盐酸等体积混合所得碱性溶液中: 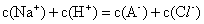 在25°C.100mLNH4Cl溶液中:
在25°C.100mLNH4Cl溶液中:
 >
> 0.1 mol·L-1的NaHCO3溶液中:c(Na+)+c(H+)=c(HCO
0.1 mol·L-1的NaHCO3溶液中:c(Na+)+c(H+)=c(HCO )+2c(CO
)+2c(CO )+c(OH-) 等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
)+c(OH-) 等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
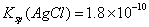 ,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到
,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到 mol·L-1C.25°时,0.1mol·L-1Na2CO3溶液中水电离出来的OH-浓度大于0.1mol·L-1NaOH溶液中水电离出来的OH-浓度 室温下,0.1mol·L-1NaHA溶液的pH=4,则有
mol·L-1C.25°时,0.1mol·L-1Na2CO3溶液中水电离出来的OH-浓度大于0.1mol·L-1NaOH溶液中水电离出来的OH-浓度 室温下,0.1mol·L-1NaHA溶液的pH=4,则有
 )>c(HCO
)>c(HCO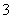 )>c(OH-) 0.1mol·L-1CH3COOH与0.05mol·L-1NaOH溶液等体积混合(pH<7): c(CH3COO-)>c(Na+)>cCH3COOH)>c(H+) 0.1 mol·L-1Na2CO3与0.05mol·L-1 NaHCO3溶液等体积混合: 5c(Na+)=3[c(CO
)>c(OH-) 0.1mol·L-1CH3COOH与0.05mol·L-1NaOH溶液等体积混合(pH<7): c(CH3COO-)>c(Na+)>cCH3COOH)>c(H+) 0.1 mol·L-1Na2CO3与0.05mol·L-1 NaHCO3溶液等体积混合: 5c(Na+)=3[c(CO )+c(HCO
)+c(HCO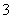 )+c(H2CO3)] 在0.1 mol·L-1 NaHC2O4溶液(pH<7)中:c(OH-)+c(C2O
)+c(H2CO3)] 在0.1 mol·L-1 NaHC2O4溶液(pH<7)中:c(OH-)+c(C2O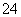 )=c(H+)+c(H2C2O4)
)=c(H+)+c(H2C2O4)
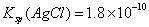 ,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到
,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到 mol·L-1 C.25°时,0.1mol·L-1Na2CO3溶液中水电离出来的OH-浓度大于0.1mol·L-1NaOH溶液中水电离出来的OH-浓度 室温下,0.1mol·L-1NaHA溶液的pH=4,则有
mol·L-1 C.25°时,0.1mol·L-1Na2CO3溶液中水电离出来的OH-浓度大于0.1mol·L-1NaOH溶液中水电离出来的OH-浓度 室温下,0.1mol·L-1NaHA溶液的pH=4,则有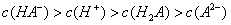
 ) > c(H+) > c(
) > c(H+) > c( ) > c(OH−) 两溶液中均有c(Na+) + c(H+) = c(
) > c(OH−) 两溶液中均有c(Na+) + c(H+) = c( ) + c(
) + c( ) + c(OH−) 两溶液中均有c(H+) + c(H2RO3) = c(
) + c(OH−) 两溶液中均有c(H+) + c(H2RO3) = c( ) + c(OH−) 两溶液中c(Na+)、c(
) + c(OH−) 两溶液中c(Na+)、c( )、c(
)、c( )分别对应相等
)分别对应相等
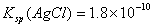 ,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到
,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到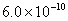 mol·L-1 C.25°时,0.1mol·L-1Na2CO3溶液中水电离出来的OH-浓度大于0.1mol·L-1NaOH溶液中水电离出来的OH-浓度 室温下,0.1mol·L-1NaHA溶液的pH=4,则有
mol·L-1 C.25°时,0.1mol·L-1Na2CO3溶液中水电离出来的OH-浓度大于0.1mol·L-1NaOH溶液中水电离出来的OH-浓度 室温下,0.1mol·L-1NaHA溶液的pH=4,则有
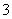 )+c(CO
)+c(CO )+c(H2CO3) pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合: c(Na+)>c(CH3COO-)>c(OH-)>c(H+) 在0.1 mol·L.-1 Na2S溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)
)+c(H2CO3) pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合: c(Na+)>c(CH3COO-)>c(OH-)>c(H+) 在0.1 mol·L.-1 Na2S溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)