你可能感兴趣的试题
5%Na2CO3、1%NaOH、5%NaOH、5%NaHCO3 5%NaOH、1%NaOH、5%Na2CO2、5%NaHCO3 5%NaHCO3、5%Na2CO3、1%NaOH、5%NaOH 5%Na2CO3、1%NaOH、5%NaHCO3、5%NaOH 5%NaHCO3、5%Na2CO3、5%NaOH、1%NaOH
向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液, 又有CaCO3沉淀生成 向Na2 CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原溶液中Na2CO3的物质 的量之比为1:2 等质量的NaHCO3和Na2 CO3分别与足量稀盐酸反应,在同温同压下,生成的CO2体积相同 向Na2CO3饱和溶液中通入足量CO2,有NaHCO3 结晶析出
碳碳键键长:乙烯>苯 密度:一氯乙烷>一氯丁烷 热稳定性: NaHCO3>Na2CO3>H2CO3 沸点:H2O>H2S>H2Se
溶液中水电离出的OH—个数:②>① 溶液中阴离子的物质的量浓度之和:②>① ①溶液中:c(CO )>c(H2CO3) ②溶液中:c(HCO
)>c(H2CO3) ②溶液中:c(HCO )>c(H2CO3)
)>c(H2CO3)
滴有酚酞的NaHCO3溶液呈浅红色,微热后红色加深,是因为NaHCO3分解生成了Na2CO3 钠保存在煤油中,是因为煤油不与钠发生反应,钠比煤油密度大,煤油可以使钠隔绝空气和水蒸气 用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO2、H2O与Na2O2的反应是放热反应 钠长期暴露在空气中的产物是Na2CO3,原因是钠与氧气生成的Na2O与水和二氧化碳反应
和酸反应放出等量的CO2所消耗的酸比Na2CO3少 相同温度下溶解度比NaCO3要大 热稳定性比Na2CO3小 NaHCO3只能和酸作用不能和碱作用
pH = a的氨水溶液,稀释10倍后,其pH = b,则a = b + 1 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 在Na2C2O4稀溶液中,c(OH-) = c(H+) + c(HC2O4—) + 2c(H2C2O4) 0.1 mol/L Na2CO3溶液与0.1 mol/L NaHCO3溶液等体积混合: 3c(Na+) = 2[c(CO32—) + c(HCO3—) + c(H2CO3) ]
人体血液pH通常在6--7之间 血液中乳酸过多时,就与NaHCO3发生反应,生成乳酸钠和H2CO3 血液中Na2CO3过多时,就与H2CO3结合形成NaHCO3 血液中CO2过多会刺激神经中枢,促进呼吸活动将CO2排出
工业上通过电解熔融状态MgCl2制取金属镁 用澄清的石灰水可鉴别NaHCO3和Na2CO3 在第②、④步骤中,溴元素均被氧化 制取NaHCO3的反应是利用其溶解度小于NaCl
溶解度:NaHCO3 > Na2CO3 酸性:H2SiO3 > H2CO3 熔点:金刚石 > 晶体硅 热稳定性:NaHCO3 > Na2CO3
酸性HY>HX 结合H+的能力Y->CO >X->HCO
>X->HCO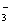 溶液的碱性:NaX>Na2CO3>NaY>NaHCO3 HX和HY酸性相同但比H2CO3弱
溶液的碱性:NaX>Na2CO3>NaY>NaHCO3 HX和HY酸性相同但比H2CO3弱
放Na2CO3的一端托盘下沉 放NaHCO3的端托盘下沉 仍保持平衡 无法判断

 )>c(H2CO3) ②溶液中:c(HCO
)>c(H2CO3) ②溶液中:c(HCO )>c(H2CO3)
)>c(H2CO3)
 >X->HCO
>X->HCO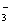 溶液的碱性:NaX>Na2CO3>NaY>NaHCO3 HX和HY酸性相同但比H2CO3弱
溶液的碱性:NaX>Na2CO3>NaY>NaHCO3 HX和HY酸性相同但比H2CO3弱