你可能感兴趣的试题
电离平衡常数越小,表示弱电解质的电离能力越弱 电离平衡常数与温度无关 不同浓度的同一弱电解质,其电离平衡常数不同 多元弱酸各步电离平衡常数相互关系为:K1〈K2〈K3
温度:T.1>T.2>T.3 正反应速率:v(a)>v(c) v(b)>v(d) 平衡常数:K.(a)>K.(c) K.(b)=K.(d) 平均摩尔质量:M.(a)M.(d)
该反应的化学平衡常数K.约为0.043 增加 的物质的量,B.的平衡转化率不变 C.增大该体系的压强,平衡正向移动,化学平衡常数增大 A.的平衡转化率是40%
电离平衡常数(K.)与温度无关 H2CO3的电离常数表达式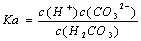 同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K123
同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K123
该反应的化学平衡常数K.约为0.043 增加 的物质的量,B.的平衡转化率不变 C.增大该体系的压强,平衡正向移动,化学平衡常数增大 A.的平衡转化率是40%
不同的可逆反应,反应物的性质不同,平衡常数是相等的 对可逆反应来说,平衡常数越大,表示反应达到平衡时生成物浓度和反应物浓度的比值越大 对于同一个可逆反应,在不同的温度下,平衡常数有相同的数值 对可逆反应来说,平衡常数越大,表示反应完成的程度越小,物质的转化率越大
不同浓度的同一弱电解质,其电离常数(K.)不同 温度越高,化学平衡常数一定越大 平衡常数发生变化,化学平衡必定发生移动,达到新的平衡 化学平衡发生移动,平衡常数必发生变化
温度:T1>T2>T3 正反应速率:v(a)>v(c) v(b)>v(d) 平衡常数:K(a)>K(c) K(b)=K(d) 平均摩尔质量:M(a)M(d)
在任何条件下,化学平衡常数K.都是一个定值 当改变反应物的浓度时,化学平衡常数会发生改变 化学平衡常数K.只与温度有关,与反应物浓度、体系的压强无关 化学平衡常数K.与反应物的转化率是一一对应的
平均摩尔质量:a>c b正反应速率:a>c b>d 平衡常数:a>b b=d 平衡时a点一定满足CO与H2的物质的量之比为1:2
反应达到平衡时,X的转化率为80% 该反应的平衡常数表达式为K= 增大压强其平衡常数不变,但使平衡向生成Z的方向移动 改变温度可以改变此反应的平衡常数
增大压强其平衡常数不变,但使平衡向生成Z的方向移动 改变温度可以改变此反应的平衡常数
反应物的转化率不随起始浓度而变 一种反应物的转化率随另一种反应物的起始浓度不同而异 平衡常数随起始浓度不同而变 平衡常数不随温度变化
[H+]随温度的升高而降低 水的电离过程是吸热的 水的电离平衡常数与浓度、温度有关 在35℃时,[H+] > [OH─]
达平衡后升温,反应速率增大,压强减小 其他条件不变,增加压强能提高CO的转化率 该反应ΔH.>0 830℃时,在2L.的密闭容器中加入4 mol CO(g)和4 mol H2O(g),平衡时,CO的转化率是50%
不同的可逆反应,反应物的性质不同,平衡常数是相同的 对可逆反应来说,平衡常数越大,表示反应达到平衡时生成物浓度和反应物浓度的比值越大 对于同一个可逆反应,在不同温度下,平衡常数有相同的数值 对于可逆反应来说,平衡常数越大,也就是反应完成的程度越小,物质的转化率越大
不同的可逆反应,反应物的性质不同,平衡常数是相同的 对可逆反应来说,平衡常数越大,表示反应达到平衡时生成物浓度和反应物浓度的比值越大 对于同一个可逆反应,在不同温度下,平衡常数有相同的数值 对可逆反应来说,平衡常数越大,也就是反应完成的程度越小,物质的转化率越大

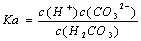 同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K1
同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K1 增大压强其平衡常数不变,但使平衡向生成Z的方向移动 改变温度可以改变此反应的平衡常数
增大压强其平衡常数不变,但使平衡向生成Z的方向移动 改变温度可以改变此反应的平衡常数