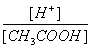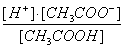你可能感兴趣的试题
9―10之间、0.1 9―11之间、0.2 12―13之间、0.2 13、0.2
0.1 mol锌片投入到100 mL 1 mol・L-1的盐酸溶液中 1 mol MnO2粉末与400 mL10 mol・L-1的盐酸共热 常温下1mol铝片投入到200mL18.4mol・L-1硫酸中 常温下 1 mol铜片投入含4molHNO3的浓硝酸中
将1L. 0.1mol・L-1的Ba(OH)2溶液加水稀释为2L,pH=13 pH=3的醋酸溶液加水稀释100倍,pH=5 pH=4的H2SO4加水稀释100倍,溶液中由水电离产生的[H+]=1×10-6mol・L-1 pH=8的NaOH溶液加水稀释100倍,其pH=6
等于 6.7mol/L 大于6.7mol/L 小于6.7mol/L 以上都不对
9~11;0.1 9~11;0.2 12~13;0.2 13;0.1
溶液中的c(CH3COO-) 溶液中的c(H+) 醋酸的电离平衡常数 溶液中的c(OH-)
常温下,4体积pH=9的Ca(OH)2溶液与1体积pH=13的NaOH溶液混合后,氢离子浓度是1×10-13mol/L 用盐酸滴定氨水时,能用酚酞做指示剂(酚酞的变色范围是pH=8~10) 加热Na2CO3溶液、NaHCO3溶液和CO2与H2O饱和溶液,它们的pH值都会上升 pH相同的氨水、氢氧化钠用蒸馏水稀释到原来的x倍、y倍至pH仍相同,则x<y
常温下,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 常温下,将pH =10的氨水稀释后,溶液中所有离子浓度都减小 常温下,0.1 mol/L Na2S溶液中存在:c(OH-) = c(H+) + c(HS-) + c(H2S) 常温下,pH为1的0.1 mol/L HA溶液与0.1 mol/L NaOH溶液恰好完全反应时,溶液中一定存在: c (Na+) = c(A-) > c(OH-) = c(H+)
电解熔融氯化钠,在阴极和阳极上析出产物的物质的量之比 中和体积相同、pH相同的硫酸和盐酸消耗NaOH的物质的量之比 1 mol・L.-1氨水溶液与0.5 mol・L.-1氨水溶液中c(OH-)之比 物质的量相同的水和乙醇与足量金属钠反应产生氢气的体积之比
[CH3COOH] [H+] 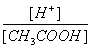
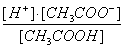
加入适量的氢氧化钠固体 将溶液稀释到原体积的 10倍 加入等体积0.2 mol·L-1氨水 降低溶液的温度
9~11之间;0.1 9~11之间;0.2 12~13之间;0.2 13;0.1
常温下,pH等于14与pH等于12的两种NaOH溶液等体积混合后, c(H+)=(10-14+10-10)/2 常温下,浓度为1×10-10 mol·L.-1的KOH溶液的pH为7 氨水加水稀释,溶液中除水以外的所有粒子的浓度都减小 常温下,pH等于1的盐酸溶液中水的电离程度与pH等于13的Ba(OH)2溶液中水的电离程度相等
某吸热反应能自发进行,因此该反应是熵增反应 常温下, 0.1 mol/L氨水(电离度α=1%)的pH为11: 用蒸馏水润湿的试纸测溶液的pH,不一定会使结果偏低 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率