你可能感兴趣的试题
H2(g)与O2(g)反应生成H2O(g)是吸热反应 1 mol H2O(g)转变成1 mol H2O(l)放出44.0 kJ热量 1 mol H2O(l)转变成1 mol H2O(g)放出44.0 kJ热量 1 mol H2O(g)转变成1 mol H2O(l)放出88.0 kJ热量
H2O(g)=H2(g)+1/2O2(g) △H.(298K)=+242KJ/mol 2H2(g)+O2(g)=2H2O(1) △H.(298K)=-484KJ/mol H2(g)+1/2O2(g)=H2O(g) △H.(298K)=+242KJ/mol 2H2(g)+O2(g)=2H2O(g) △H.(298K)=+484KJ/mol
H2燃烧生成1 mol H2O(g)时,放出241.8 kJ的热量 O2前面的 表示参加反应的O2的分子数目
表示参加反应的O2的分子数目
甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1 500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-38.6 kJ·mol-1 已知在120 ℃、101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为H2(g)+1/2O2(g)===H2O(g) ΔH=-242 kJ·mol-1 25 ℃、101 kPa时,强酸与强碱的稀溶液发生反应的中和热为57.3 kJ·mol-1,硫酸稀溶液与氢氧化钾稀溶液反应的热化学方程式为:H2SO4(aq)+2KOH(aq)= K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1 已知在120 ℃、101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为H2(g)+1/2O2(g)===H2O(g) ΔH=-242 kJ·mol-1 25 ℃、101 kPa时,强酸与强碱的稀溶液发生反应的中和热为57.3 kJ·mol-1,硫酸稀溶液与氢氧化钾稀溶液反应的热化学方程式为:H2SO4(aq)+2KOH(aq)= K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1
标况下,燃烧1molS.放出的热量为297.23 kJ S ( g ) + O2 ( g ) = SO2 ( g ) 放出的热量大于297.23 kJ S ( g ) + O2 ( g ) = SO2 ( g ) 放出的热量小于297.23 kJ 形成1 mol SO2 的化学键所释放的总能量大于断裂 1 molS ( s )和 1mol O2 ( g )的化学键所吸收的总能量
H2燃烧生成1mol H2O(g)时,放出241.8 kJ的热量 O2前面的 表示参加反应的O2的分子数目 298K时,lmolH2完全燃烧生成稳定的氧化物时放出的热量为285.8 kJ 1mol液态水变成水蒸气时吸收44 kJ的热量
表示参加反应的O2的分子数目 298K时,lmolH2完全燃烧生成稳定的氧化物时放出的热量为285.8 kJ 1mol液态水变成水蒸气时吸收44 kJ的热量
1分子H2和Cl2反应,放出热量184.6kJ 在101kPa,25oC的条件下,1mol H2(g)和1mol Cl2(g)完全反应生成2mol HCl(g),放出的热量为184.6kJ 1mol H2(g)完全反应生成2mol HCl(g),放出的热量为184.6kJ 在101kPa,25oC的条件下,1mol H2和1mol Cl2完全反应生成2mol HCl(g),吸收的热量为184.6kJ
△H3=△H1+2△H2 △H3=△H1+△H2 △H3=△H1-2△H2 △H3=△H1-△H2
138kPa 11.99kPa 4.9kPa 49kPa
△H3=△H1+2△H2 △H3=△H1+△H2 △H3=△H1﹣2△H2 △H3=△H1﹣△H2
1 molS.完全燃烧时放出的热量为297.23 kJ S(g)+O2(g)===SO2(g)放出的热量大于297.23 kJ S(g)+O2(g)===SO2(g)放出的热量小于297.23 kJ 形成1 mol SO2的化学键所释放的总能量大于断裂1 mol S(s)+1 mol O2(g)的化学键所吸收的总能量
S(s)+O2(g)= SO2(g) ΔH=-299.6kJ/mol 2S(s)+2O2(g)=2SO2(g) ΔH=+599.2kJ/mol S(s)+O2(g)= SO2(g) ΔH=+299.6kJ/mol 2S(s)+2O2(g)= 2SO2(g) ΔH=-299.6kJ/mol
H2O(g)===H2(g)+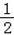 错误!未找到引用源。O2(g) ΔH.=+242 kJ·mol-1 2H2(g)+O2(g)===2H2O(l) ΔH.=-484 kJ·mol-1 H2(g)+
错误!未找到引用源。O2(g) ΔH.=+242 kJ·mol-1 2H2(g)+O2(g)===2H2O(l) ΔH.=-484 kJ·mol-1 H2(g)+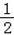 错误!未找到引用源。O2(g)===H2O(g) ΔH.=+242 kJ·mol-1 2H2(g)+O2(g)===2H2O(g) ΔH.=484 kJ·mol-1
错误!未找到引用源。O2(g)===H2O(g) ΔH.=+242 kJ·mol-1 2H2(g)+O2(g)===2H2O(g) ΔH.=484 kJ·mol-1
H2(g)与O2(g)反应生成H2O(g)是吸热反应 1 molH2O(g)转变成1 molH2O(l)放出44.0kJ热量 1 molH2O(l)转变成1 molH2O(g)放出44.0kJ热量 1 molH2O(g)转变成1 molH2O(l)放出88.0kJ热量
ΔH3=ΔH1+2ΔH2 Δ H3=ΔH1+ΔH2 ΔH3=ΔH1-2ΔH2 Δ H3=ΔH1-ΔH2

 表示参加反应的O2的分子数目
表示参加反应的O2的分子数目
 2NH3(g) ΔH=-38.6 kJ·mol-1 已知在120 ℃、101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为H2(g)+1/2O2(g)===H2O(g) ΔH=-242 kJ·mol-1 25 ℃、101 kPa时,强酸与强碱的稀溶液发生反应的中和热为57.3 kJ·mol-1,硫酸稀溶液与氢氧化钾稀溶液反应的热化学方程式为:H2SO4(aq)+2KOH(aq)= K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1 已知在120 ℃、101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为H2(g)+1/2O2(g)===H2O(g) ΔH=-242 kJ·mol-1 25 ℃、101 kPa时,强酸与强碱的稀溶液发生反应的中和热为57.3 kJ·mol-1,硫酸稀溶液与氢氧化钾稀溶液反应的热化学方程式为:H2SO4(aq)+2KOH(aq)= K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1
 表示参加反应的O2的分子数目 298K时,lmolH2完全燃烧生成稳定的氧化物时放出的热量为285.8 kJ 1mol液态水变成水蒸气时吸收44 kJ的热量
表示参加反应的O2的分子数目 298K时,lmolH2完全燃烧生成稳定的氧化物时放出的热量为285.8 kJ 1mol液态水变成水蒸气时吸收44 kJ的热量
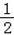 错误!未找到引用源。O2(g) ΔH.=+242 kJ·mol-1 2H2(g)+O2(g)===2H2O(l) ΔH.=-484 kJ·mol-1 H2(g)+
错误!未找到引用源。O2(g) ΔH.=+242 kJ·mol-1 2H2(g)+O2(g)===2H2O(l) ΔH.=-484 kJ·mol-1 H2(g)+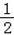 错误!未找到引用源。O2(g)===H2O(g) ΔH.=+242 kJ·mol-1 2H2(g)+O2(g)===2H2O(g) ΔH.=484 kJ·mol-1
错误!未找到引用源。O2(g)===H2O(g) ΔH.=+242 kJ·mol-1 2H2(g)+O2(g)===2H2O(g) ΔH.=484 kJ·mol-1