你可能感兴趣的试题
△H.=+260.7kJ・mol-1 △H.=-260.7kJ・mol-1 △H.=-442.3kJ・mol-1 △H.=+442.3kJ・mol-1
Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s) ΔH.=+317.3kJ·mol-1 Zn+Ag2O=ZnO+2Ag ΔH.=+317.3kJ·mol-1 Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s) ΔH.=-317.3kJ 2Zn(s)+2Ag2O(s)=2ZnO(s)+4Ag(s) ΔH.=-634.6 kJ·mol-1
△H=+260.7kJ・mol △H= ―260.7kJ・mol
△H= ―260.7kJ・mol △H= 一442.3kJ・mol
△H= 一442.3kJ・mol △H=+442.3kJ・mol
△H=+442.3kJ・mol
ΔH.=+260.7 kJ・mol-1 .ΔH.=-260.7 kJ・mol-1 .ΔH.=-444.2 kJ・mol-1 ΔH.=+444.2 kJ・mol-1
Zn(s)十Ag2O(s)====ZnO(s)+2Ag(s),△H=317.3kJ/mol Zn+Ag2O=====ZnO+2Ag,△H=317.3kJ/mol Zn(s)+Ag2O(s)=====ZnO(s)+2Ag(s),△H=-317.3kJ/mol 2Zn(s)+2Ag2O(s)=====2ZnO(s)+4Ag(s),△H=-317.3kJ
-441.8kJ/mol -254.6kJ/mol -438.9kJ/mol -260.4kJ/mol
ΔH.=+260.7 kJ·mol-1 ΔH.= —260.7 kJ·mol-1 ΔH.= —444.2 kJ·mol-1 ΔH.=+444.2 kJ·mol-1
热化学反应方程式中的化学计量数表示分子数 该反应的ΔH2大于零 ΔH1是氢气的燃烧热 ∣△H1∣<∣△H2∣
Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)ΔH.=+317.3kJ·mol-1 Zn+Ag2O===ZnO+2Ag ΔH.=+317.3kJ·mol-1 Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)ΔH.=-317.3kJ 2Zn(s)+2Ag2O(s)===2ZnO(s)+4Ag(s)ΔH.=-634.6 kJ·mol-1
热化学反应方程式中的化学计量数表示分子数 该反应的ΔH2大于零 ΔH1时氢气的燃烧热 ∣△H1∣<∣△H2∣

 △H= ―260.7kJ・mol
△H= ―260.7kJ・mol △H= 一442.3kJ・mol
△H= 一442.3kJ・mol △H=+442.3kJ・mol
△H=+442.3kJ・mol

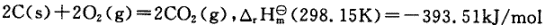 C(s)+O
C(s)+O (g)=COz(g)
(g)=COz(g) 