你可能感兴趣的试题
第IA族元素铯的两种同位素137Cs比133Cs多4个质子 同周期元素(除0族元素外)从左到右,原子半径逐渐减小 第VIIA族元素从上到下,其氢化物的稳定性逐渐增强 同主族元素从上到下,单质的熔点逐渐降低
第IA.族元素铯的两种同位素137Cs比133Cs多4个质子 同周期元素(除0族元素外)从左到右,原子半径逐渐减小 第 ⅦA.元素从上到下,其氢化物的稳定性逐渐增强 同主族元素从上到下,单质的熔点逐渐降低
元素周期表为发展物质结构理论提供了客观依据 半导体材料都是周期表里金属与非金属接界处的元素 原子量较小的元素在地壳中含量较少,原子量较大的元素在地壳中含量较多 元素周期律从自然科学上有力地论证了事物变化的量变引起质变的规律性
离子半径:S2->Cl->Ca2+ 原子半径:Ca>S>Cl 热稳定性:HCl>H2S>H2Se 酸性HClO444
元素周期表为发展物质结构理论提供了客观依据 半导体材料都是周期表里金属与非金属接界处的元素 原子量较小的元素在地壳中含量较少,原子量较大的元素在地壳中含量较多 元素周期律从自然科学上有力地论证了事物变化的量变引起质变的规律性
离子半径:S2->Cl->Ca2+ 原子半径:Ca>S.>Cl 热稳定性:HCl>H2S>H2Se 酸性:HClO4<HBrO4<HIO4
第IA.族元素铯的两种同位素137Cs比133Cs多4个质子 同周期元素(除0族元素外)从左到右,原子半径逐渐减小 第 ⅦA.族元素从上到下,其氢化物的稳定性逐渐增强 同主族元素从上到下,单质的熔点逐渐降低
离子半径:S2->Cl->Ca2+ 原子半径:Ca>S.>Cl 热稳定性:HCl>H2S>H2Se 酸性:HClO4<HBrO4<HIO4
第ⅠA族元素铯的两种同位素137Cs比133Cs多4个质子 同周期元素(除0族元素外)从左到右,原子半径逐渐减小 第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强 同主族元素从上到下,单质的熔点逐渐降低
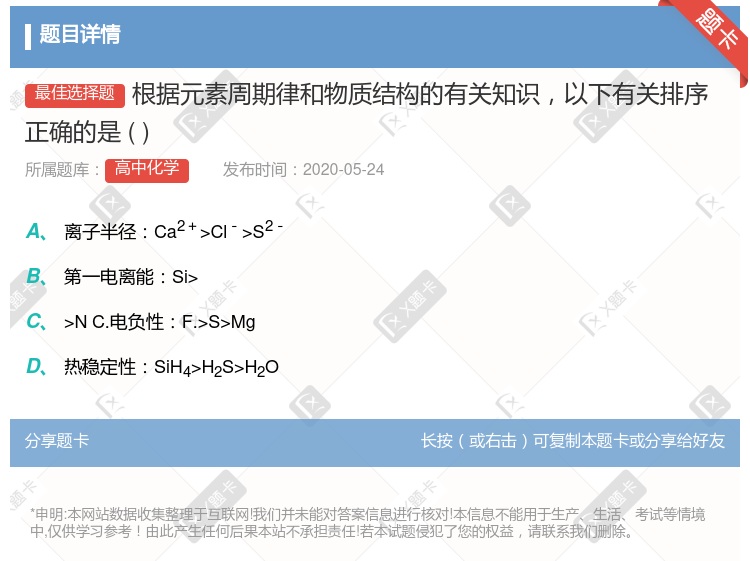
离子半径:Ca2+>Cl->S2- 第一电离能:Si> >N C.电负性:F.>S>Mg 热稳定性:CH4>H2S>NH3
同种元素的原子均有相同的质子数和中子数 同主族元素的简单阴离子还原性越强,水解程度越大 同周期金属元素的化合价越高,其原子失电子能力越强 短周期第ⅣA.与ⅦA.族元素的原子间构成的分子,均满足原子最外层8电子结构
第IA.族元素铯的两种同位素137Cs比133Cs多4个质子 元素周期表有十八个纵行,共十六个族 第 ⅦA族元素从上到下,其氢化物的稳定性逐渐增强 同主族元素从上到下,单质的熔点逐渐降低