你可能感兴趣的试题
M.点所示溶液中可能存在c(Cl-)>c(NH4+) N.点所示溶液中可能存在c(NH4+)+c(NH3•H2O)=c(Cl-) Q.点盐酸与氨水恰好中和 M.点到Q.点所示溶液中水的电离程度先变大后减小
c(H+)=1×10-7mol·L-1的溶液 水电离的H.+和OH-浓度相等的溶液 pH+pOH=14的溶液 pH=pOH的溶液
c(H+)=1×10-7mol/L的溶液 pH=pOH的溶液 〔提示:pOH=-lgc(OH-)〕 pH=14-pOH 的溶液 由等体积、等物质的量浓度的一元酸跟氢氧化钠溶液混合后所形成的溶液
M.点所示溶液c(NH4+)+c(NH3·H2O)= c(Cl-) N.点所示溶液中:c(NH4+)>c(Cl-) Q.点所示消耗盐酸的体积等于氨水的体积 M.点和N.点所示溶液中水的离子积相同
c(H+)=1×10-7 mol∙L-1的溶液 pH=pOH的溶液 pH=14-pOH的溶液 pOH=0的溶液
M.点所示溶液中c(NH4+)+c(NH3·H2O)=c(Cl-) N.点所示溶液中c(NH4+)>c(Cl-) Q.点消耗盐酸的体积等于氨水的体积 M.点和N.点所示溶液中水的电离程度相同
HX、HY都是弱酸,且Ka(HX)>Ka(HY) 图中pOH随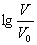 变化始终满足直线关系
变化始终满足直线关系 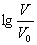 =3时,NaX溶液中所含离子总数小于NaY溶液 分别向稀释前的两种溶液加盐酸至pH=7时,c(X-)=c(Y-)
=3时,NaX溶液中所含离子总数小于NaY溶液 分别向稀释前的两种溶液加盐酸至pH=7时,c(X-)=c(Y-)
此温度下,水的离子积常数为1.0×10-2a M、N.两点所示的溶液中,水的电离程度相同 Q 点消耗的NaOH 溶液的体积等于HA 洛液的体积 N点溶液D.水稀释,C.(A-)/C(HA )减小
此温度下,水的离子积常数为1.0×10-2a M、N.两点所示的溶液中,水的电离程度相同 Q 点消耗的NaOH 溶液的体积等于HA 洛液的体积 N点溶液D.水稀释,C.(A-)/C(HA )减小
稀盐酸中加一定量CaCO3(横坐标是碳酸钙的质量, 纵坐标为气体体积) Ca(OH)2溶液中滴入溶液(横坐标是Na2CO3溶液的 体积,纵坐标为沉淀质量) 稀盐酸滴加到AgNO3溶液中(横坐标是稀盐酸的体积,纵坐标为溶液的导电能力) 稀硫酸滴加到Ba(OH)2溶液中(横坐标是稀硫酸的体积,纵坐标为溶液的导电能力)
将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 已知pOH=-lg[c(OH-)],又知体温下正常人的血液pH=7.35,则血液的pOH为6.65 KCN溶液中有剧毒HCN挥发出来,为了减少HCN的生成,最佳方法是加入KOH
M.点所示溶液中c(NH4+)+c(NH3·H2O)=c(Cl-) N.点所示溶液中溶质一定含NH4Cl,可能还含HCl Q.点消耗盐酸的体积等于氨水的体积 Q.点所示溶液中c(NH4+)> c(Cl-)> c(NH3·H2O)> c(OH-)> c(H+)
a=12 盐酸与MOH溶液恰好中和时溶液pH=6.5 滴入盐酸体积达26.0 mL时,溶液中微粒浓度c(Cl﹣)>c(H+)>c(M+)>c(MOH)>c(OH﹣) t℃时,MOH的Kb>1.0×10﹣3
稀盐酸中滴加NaOH溶液 稀盐酸中滴加Ba(OH)2溶液 稀HNO3中滴加NaOH溶液 稀H2SO4中滴加Ba(OH)2溶液
N点处pH>pOH,则N点处所示溶液呈酸性 该温度下水的离子积K.w=1×10−2a Q点所示溶液呈中性,则M、N、Q三点中只有Q点溶液 中水的电离出的c(H+)与水的电离c(OH−)相等 M点所示溶液的导电能力强于Q点
Q点消耗氨水溶液的体积等于HCl溶液的体积 M点所示溶液导电能力强于Q.点 M点和N.点所示溶液中水的电离程度相同 N点所示溶液中c(NH4+) > c(OH-)
某温度下,不论何种水溶液中c(H+)·c(OH-)乘积相等,即水的离子积是一个常数 醋酸钠和醋酸的混合液中若c(Na+)=c(CH3COO-),则溶液中c(H+)=c(OH-) 如果定义pOH=-lgc(OH-),则常温下某水溶液中的pOH和pH之和等于14 某水溶液由于条件的改变,如果氢离子浓度变小,则氢氧根离子浓度一定变大
c(H+)=1×10-7mol/L的溶液 pH=pOH的溶液 〔提示:pOH=-lgc(OH-)〕 pH=14-pOH 的溶液 由等体积、等物质的量浓度的一元酸跟氢氧化钠溶液混合后形成的溶液
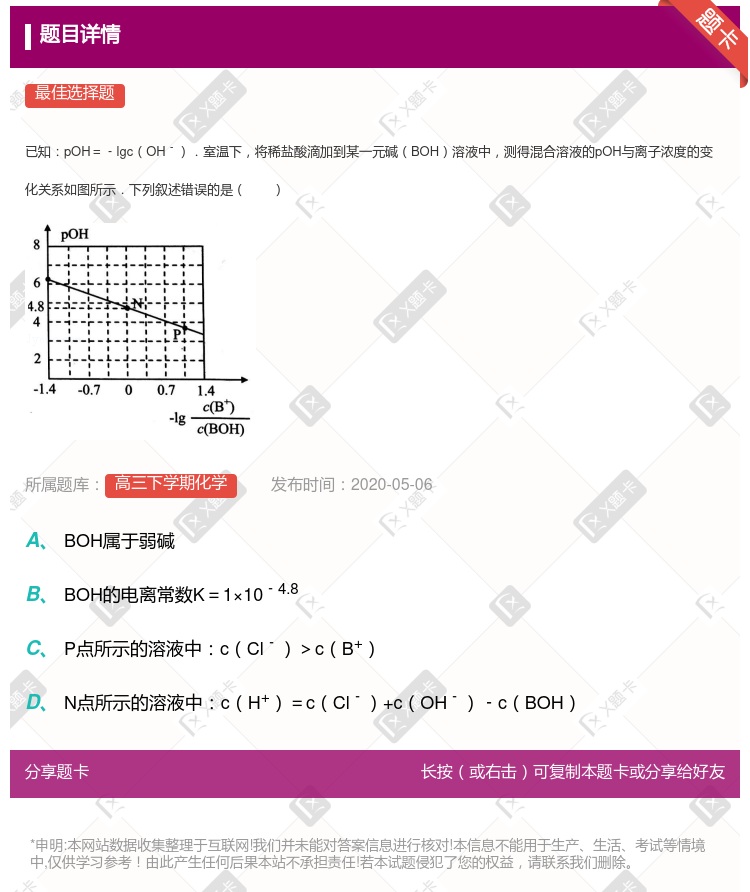
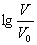 变化始终满足直线关系
变化始终满足直线关系 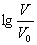 =3时,NaX溶液中所含离子总数小于NaY溶液 分别向稀释前的两种溶液加盐酸至pH=7时,c(X-)=c(Y-)
=3时,NaX溶液中所含离子总数小于NaY溶液 分别向稀释前的两种溶液加盐酸至pH=7时,c(X-)=c(Y-)