你可能感兴趣的试题
在一定浓度下,平衡常数值越大则酸的电离度也越大 在一定浓度下,平衡常数值越大则酸的电离度越小 平衡常数值越大则溶液的浓度越大 平衡常数值越大则溶液的浓度越小
常温下,等浓度、等体积的NaHCO3 溶液pH小于 溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和
溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和  溶液中所含离子总数前者小于后者
溶液中所含离子总数前者小于后者  水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
电离平衡常数能衡量电解质电离的相对强弱 电离平衡常数不随浓度变化而变化 电离平衡常数与温度有关 电离平衡常数不随任何条件而改变
电离平衡常数越小,表示弱电解质的电离能力越弱 电离平衡常数与温度无关 不同浓度的同一弱电解质,其电离平衡常数不同 多元弱酸各步电离平衡常数相互关系为:K1〈K2〈K3
对于弱电解质,电离平衡常数不因浓度改变而改变,但随温度改变而改变 弱电解质的电离平衡常数愈大,电解质愈易电离 电离平衡常的大小反映了弱电解质的相对强弱 对于弱电解质,电离平衡常数随浓度改变而
在一定浓度下,平衡常数值越大则碱的电离度也越大 在一定浓度下,平衡常数值越大则碱的电离度越小 平衡常数值越大则溶液的浓度越大 平衡常数值越大则溶液的浓度越小
不同浓度的同一弱电解质,其电离平衡常数(K.)不同 电离平衡常数(K.)越小,表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K.1<K.2<K.3 CH3COOH溶液中加入少量CH3COONa溶液,电离常数减小
化学反应速率v 化学平衡常数K. 水的离子积常数Kw 弱酸的电离常数Ka
CH3COONa NaClO Na2CO3 Na3PO4
在一定浓度下,平衡常数值越大则酸的电离度也越大 在一定浓度下,平衡常数值越大则酸的电离度越小 平衡常数值越大则溶液的浓度越大 平衡常数值越大则溶液的浓度越小
一定温度下,弱酸的电离常数越大,酸性越强 醋酸的电离常数Ka和醋酸钠的水解常数Kh之间的关系为:Ka·Kh=Kw 溶度积越小,该物质一般越容易在溶液中形成沉淀 合成氨的反应,正反应的平衡常数和逆反应的平衡常数相同。
电离平衡常数能衡量电解质电离的相对强弱 电离平衡常数不随浓度变化而变化 电离平衡常数与温度有关 电离平衡常数不随任何条件而改变
常温下,等浓度、等体积的NaHCO3 溶液pH小于 溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和
溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和 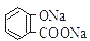 溶液中所含离子总数前者小于后者
溶液中所含离子总数前者小于后者 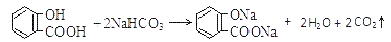 水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
电离平衡常数(K.)与温度无关 H2CO3的电离常数表达式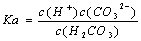 同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K123
同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K123
各平衡常数的大小与温度有关 若温度升高则各平衡常数一定增大 平衡常数的大小能说明反应(或电离、溶解)进行的程度 平衡常数越大反应(或电离、溶解)程度越大
碳酸的酸性强于氢硫酸 多元弱酸的酸性主要由第一步电离决定 多元弱酸的各步电离之间无影响 向弱酸溶液中加少量NaOH固体,电离常数不变
电离平衡常数能衡量电解质电离的相对强弱 电离平衡常数不随浓度的变化而变化 电离平衡常数与温度有关 电离平衡常数不随任何条件而改变
电离度越大,电离平衡常数越大; 浓度越稀,电离度越大,电离平衡常数越大; 在相同的温度下电离度可变,而电离平衡常数不变; 多元弱酸的每一步电离平衡常数是相同的

 溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和
溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和  溶液中所含离子总数前者小于后者
溶液中所含离子总数前者小于后者  水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
 溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和
溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和 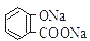 溶液中所含离子总数前者小于后者
溶液中所含离子总数前者小于后者 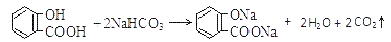 水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
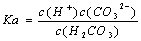 同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K1
同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K1