你可能感兴趣的试题
100℃纯水的pH=6,说明加热可导致水呈酸性 pH=4的醋酸溶液,稀释至10倍后pH=5 0.2 mol/L的盐酸与等体积水混合后pH=1(混合后溶液体积变化忽略不计) 将pH=5的硫酸溶液稀释500倍后所得溶液中c(H+):c(SO42-)=2:1
100 ℃时,纯水中c(H +)=1×10-6 mol·L-1,此时纯水显酸性 25℃时,pH=10的氨水与pH=4盐酸等体积混合,所得溶液呈酸性 25℃时,将pH=a的醋酸溶液稀释10倍后,溶液的pH=b,则b= (a+1) 25℃时, 的溶液中,Na+、CO32-、Cl-一定能大量共存
的溶液中,Na+、CO32-、Cl-一定能大量共存
0.1mol/L HCl 0.1mol/L HAc 1mol/L NH3·H2O 1mol/L HAc+1mol/L NaAc
0.1mol/LHCl 1mol/LNH3·H2O 1mol/LHAc 1mol/LHAc+1mol/LNaAc 0.1mol/LNaOH
温度的升高,纯水的pH不变 加水稀释,碳酸钠溶液的c(H+)减小 温度的升高,硫酸溶液的c(H+)基本不变 pH = 5的盐酸稀释1000倍后,溶液的pH变为8
0.1mol/LHCl 1mol/LNH·HO 1mol/LHAc 1mol/LHAc+1mol/LNaAc 0.1mol/LNaOH
0.lmol/LHCl 1mol/LNH3·H20 1mol/LHAc 1mol/LHAc+lmol/LNaAc 0.1mol/LNaOH
95℃纯水的pH<7,说明加热可导致水呈酸性 pH=3的醋酸溶液,稀释至10倍后pH=4 0.2mol/L的盐酸,与等体积水混合后pH=1 常温时,pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7
100 ℃时,纯水中c(H +)=1×10-6 mol·L-1,此时纯水显酸性 25℃时,pH=10的氨水与pH=4盐酸等体积混合,所得溶液呈酸性 25℃时,将pH=a的醋酸溶液稀释10倍后,溶液的pH=b,则b= (a+1) 25℃时,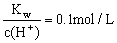 的溶液中,Na+、CO32-、Cl-一定能大量共存
的溶液中,Na+、CO32-、Cl-一定能大量共存
0.2 mol·L-1的盐酸与等体积水混合后pH=1 pH=3的醋酸溶液,稀释至10倍后pH=4 95 ℃纯水的pH<7,说明加热可导致水呈酸性 pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7
0.1mol/L HCl 1mol/L NH3·H2O 0.1mol/L HAc 1mol/L HAc +1mol/LNaAc
95℃纯水的pH<7,说明加热可导致水呈酸性 25℃时,在纯水中加入强碱溶液不会影响水的离子积常数 pH=3的醋酸溶液加水稀释10倍后pH=4 pH=3和pH=5的盐酸各10mL混合所得溶液的pH=4
95 ℃纯水的pH<7,说明加热可导致水呈酸性 pH = 3的醋酸溶液,稀释10倍后pH = 4 0.2 mol·L-1的盐酸,与等体积水混合后pH = 1 25℃与60℃时,水的pH相等
0.1mol/LHCl 1mol/LNH3·H2O 1mol/LHAc 1mol/LHAc+1mol/LNaAc 0.1mol/LNaOH
室温下,pH相同、体积相同的醋酸和盐酸两种溶液分别加水稀释2倍后,两溶液的酸性都减弱,其中,稀释后的盐酸的酸性还是比醋酸的强。 室温下,pH相同、体积相同的氨水和氢氧化钠两种溶液分别加水稀释2倍后,两溶液的pH均减小,其中,稀释后的氢氧化钠的pH比氨水的小。 室温时,0.01 mol·L.-1醋酸溶液的pH=2 室温,0.01 mol·L.-1醋酸溶液中加入等体积0.01 mol·L.-1 NaOH溶液后,所得溶液的pH=7
95℃纯水的pH<7,说明加热可导致水呈酸性 pH=13的氨水溶液稀释至10倍后pH=12 0.2 mol/L的盐酸与等体积水混合后pH=1 pH=12的氨水溶液与pH=2的氢氧化钠溶液等体积混合后pH=7
温度升高,纯水的pH不变 加水稀释,碳酸钠溶液的c(H+)减小 温度升高,硫酸溶液的c(H+)基本不变 pH=5的盐酸稀释1000倍后,溶液的pH变为8
0.1mol/LHCl 1mol/LNH ·H
·H O 1mol/LHAc 1mol/LHAc+1mol/LNaAc 0.1mol/LNaOH
O 1mol/LHAc 1mol/LHAc+1mol/LNaAc 0.1mol/LNaOH
95℃纯水的pH<7,说明加热可导致水呈酸性 pH=3的醋酸溶液,稀释至10倍后pH=4 0.2mol/L的盐酸,稀释至2倍后pH=1 pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7

 的溶液中,Na+、CO32-、Cl-一定能大量共存
的溶液中,Na+、CO32-、Cl-一定能大量共存
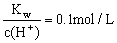 的溶液中,Na+、CO32-、Cl-一定能大量共存
的溶液中,Na+、CO32-、Cl-一定能大量共存
 ·H
·H O 1mol/LHAc 1mol/LHAc+1mol/LNaAc 0.1mol/LNaOH
O 1mol/LHAc 1mol/LHAc+1mol/LNaAc 0.1mol/LNaOH