你可能感兴趣的试题
正反应为放热反应,X.可能是气态、液态或固态 正反应为放热反应,X.一定为气态 若X.为非气态,则正反应为吸热反应 若加入少量的Z.,该平衡向左移动
物质Z.的化学计量数a = 2 若Ⅱ中气体的密度如图Ⅲ所示,则X.、Y.中 只有一种为气态 若X.、Y.均为气态,则在平衡时X.的转化率: Ⅰ﹤Ⅱ 若X.为固态、Y.为气态,则Ⅰ、Ⅱ中从开 始到平衡所需的时间:Ⅰ>Ⅱ
用X.表示该化学反应速率比用Y.表示的要快 该反应的化学方程式:3X+Y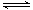 2Z 若在3min后,把Z.从反应体系中分离,平衡不移动 反应开始至2min,Z.的平均反应速率:0.1mol/(L·min)
2Z 若在3min后,把Z.从反应体系中分离,平衡不移动 反应开始至2min,Z.的平均反应速率:0.1mol/(L·min)
正反应为放热反应,X.可能是气态、液态或固态 正反应为放热反应,X.一定为气态 若X.为非气态,则正反应为吸热反应 若加入少量的Z.,该平衡向左移动
x=4 若N.中气体的密度如图Ⅲ所示,则X.、Y.都是气态 若X.为气体,Y.为非气体,则平衡时M.、N.中Z.的物质的量相等 若X.、Y.均为气体,平衡时M.中X.的转化率小于N.中X.的转化率
反应进行30 s时,正反应速率等于逆反应速率 反应进行80 s时,逆反应速率大于正反应速率 反应进行60 s时,X.的物质的量浓度为0.04 mol/L 反应进行60 s时,Y.的转化率为70%
若X.、Y.均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ 若X.、Y.不均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ a为2 平衡时Ⅰ容器的体积小于VL.
物质Z的化学计量数a=2
若Ⅱ中气体的密度如图Ⅲ所示,则X.Y中只有一种为气态
若X.Y均为气态,则平衡时x的转化率:I<Ⅱ
若X为固态.Y为气态,则Ⅰ.Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ
以X.浓度变化表示的反应速率为0.01mol/(L•S) 将容器体积变为20L,Z.的平衡浓度变为原来的1/2 若压强增大1倍,则物质Y.的转化率增大1倍 若降低温度,X.的浓度增大,则该反应的△H.>0
60s里以X.浓度变化表示的反应速率为0.001 mol/(L·s) 将容器体积变为20L.,Z.的平衡浓度变为原来的1/2 若增大压强,则物质Y.的转化率减小 若升高温度,X.的体积分数增大,则正反应的ΔH.>0
物质Z.的化学计量数a = 2
若Ⅱ中气体的密度如图Ⅲ所示,则X.、Y.中只有一种为气态
若X.、Y.均为气态,则在平衡时X.的转化率:Ⅰ﹤Ⅱ
若X.为固态、Y.为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ 
Y可能为气态 Y一定为固态或液态
Z可能为气态 Z一定为固态或液态
物质Z.的化学计量数a = 2
若Ⅱ中气体的密度如图Ⅲ所示,则X.、Y.中只有一种为气态
若X.、Y.均为气态,则在平衡时X.的转化率:Ⅰ<Ⅱ
若X.为固态、Y.为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ
物质Z的化学计量数a=2 若Ⅱ中气体的密度如图Ⅲ所示,则X.Y中只有一种为气态 若X.Y均为气态,则在平衡时X的转化率:Ⅰ>Ⅱ 若X为固态.Y为气态,则Ⅰ.Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ
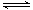 2Z 若在3min后,把Z.从反应体系中分离,平衡不移动 反应开始至2min,Z.的平均反应速率:0.1mol/(L·min)
2Z 若在3min后,把Z.从反应体系中分离,平衡不移动 反应开始至2min,Z.的平均反应速率:0.1mol/(L·min)
