你可能感兴趣的试题
两种分子的中心原子杂化类型不同,NH3为sp2型杂化,而CH4是sp3型杂化 NH3分子中N.原子形成3个杂化轨道,CH4分子中 原子形成4个杂化轨道 C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强 NH3分子中有3个σ键,而甲烷分子中有4个 σ键
凡中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体 CH4分子中的sp3杂化轨道是由4个H.原子的1s轨道和 原子的2p轨道混合起来而形成的 C.sp3杂化轨道是由同一原子中能量相近的s轨道和p轨道混合起来形成的一组能量相同的新轨道 凡AB3型的共价化合物,其中心原子A.均采用sp3杂化轨道成键
凡AB 型的共价化合物,其中心原子均采用sp
型的共价化合物,其中心原子均采用sp 杂化轨道成键 在AB
杂化轨道成键 在AB 型的共价化合物中,中心原子均采用sp杂化轨道成键 凡是中心原子采用sp
型的共价化合物中,中心原子均采用sp杂化轨道成键 凡是中心原子采用sp 杂化轨道成键后形成的分子,其空间构型都是正四面体 sp
杂化轨道成键后形成的分子,其空间构型都是正四面体 sp 杂化可分等性sp
杂化可分等性sp 杂化和不等性sp
杂化和不等性sp 杂化
杂化
凡是中心原子采取sp3杂化轨道成键的分子,其几何构型都是正四面体 CH4分子中的sp3杂化轨道是由4个H.原子的1s轨道和 原子的2p轨道混合起来而形成的 C.sp3杂化轨道是由同一个原子中能量相近的s轨道和p轨道混合起来形成的一组能量相同的新轨道 凡AB3型的共价化合物,其中心原子A.均采用sp3杂化轨道成键
凡是中心原子采取sp3杂化的分子,其立体构形都是正四面体 CH4分子中的sp3杂化轨道是由4个H.原子的1s轨道和 原子的2p轨道混合起来而形成的 C.杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对 凡AB3型的共价化合物,其中心原子A.均采用sp3杂化轨道成键
凡中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体 凡AB3型的共价化合物,其中心原子A.均采用sp3杂化轨道成键 CH4分子中的sp3杂化轨道是由4个H.原子的1s轨道和C.原子的2p轨道混合起来而形成的 sp3杂化轨道是由同一原子中能量相近的s轨道和p轨道混合起来形成的一组能量相等的新轨道
凡是中心原子采取sp3杂化轨道成键的分子其立体构型都是正四面体形 CH4分子中sp3杂化轨道是4个H.原子的1s轨道和 原子的2p轨道混合起来而形成的 C.sp3杂化轨道是由同一个原子中能量相近的s轨道和p轨道混合形成的一组能量相近的新轨道 凡AB3型的共价化合物,其中心原子A.均采用sp3杂化轨道成键
凡是中心原子采取sp3杂化轨道成键的分子立体构型都是正四面体 CH4中的sp3杂化轨道是4个H.原子的1s 轨道和 原子的2p轨道混合形成 C.sp3杂化轨道是由同一原子中能量相近的s 和p轨道混合形成的一组新轨道 凡AB3型的共价化合物,中心原子A.均采用sp3杂化轨道成键
凡是中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体 CH4分子中的sp3杂化轨道是由4个H.原子的1s 轨道和 原子的2p轨道混合形成 C.sp3杂化轨道是由同一个原子能量相近的s 轨道和p轨道混合形成的一组新轨道 凡AB3型的共价化合物,其中心原子A.均采用sp2杂化轨道成键
凡是中心原子采取sp3杂化轨道成键的分子,其空间立体结构都是正四面体 乙烯和苯分子每个碳原子都以sp2杂化轨道形成σ键、未杂化的2p轨道形成π键 苯分子C.-C之间是sp2形成的σ键,C.-H之间是未参加杂化的2p轨道形成的π键 凡是AB3型的共价化合物,其中心原子A.均采用sp3杂化轨道成键
凡是中心原子采取sp3杂化轨道成键的分子,其几何构型都是正四面体 CH4分子中的sp3杂化轨道是由4个H.原子的1s轨道和 原子的2p轨道混合起来而形成的 C.sp3杂化轨道是由同一个原子中能量相近的s轨道和p轨道混合起来形成的一组能量相同的新轨道 凡AB3型的共价化合物,其中心原子A.均采用sp3杂化轨道成键
凡是中心原子采取sp3杂化轨道成键的分子其立体构型都是正四面体形 CH4分子中的sp3杂化轨道是由4个H.原子的1s轨道和 原子的2p轨道混合起来而形成的 C.sp3杂化轨道是由同一个原子中能量相近的s轨道和p轨道混合起来形成的一组能量相近的新轨道 凡AB3型的共价化合物,其中心原子A.均采用sp3杂化轨道成键
sp3杂化轨道是由同一原子中能量相近的s轨道和p轨道混合起来形成的一组能量相近的新轨道 凡中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体 CH4分子中的sp3杂化轨道是由4个H.原子的1s轨道和C.原子的2p轨道混合起来而形成的 凡AB3型的共价化合物,其中心原子A.均采用sp3杂化轨道成键
凡是中心原子采取sp3杂化方式成键的分子其几何构型都是正四面体 CH4分子中的sp3杂化轨道是由4个H.原子的1s轨道和 原子的2p轨道混合起来而形成的 C.sp3杂化轨道是由同一个原子中能量相近的s轨道和p轨道混合起来形成的一组能量相同的新轨道 凡AB3型的共价化合物,其中心原子A.均采用sp3杂化方式成键
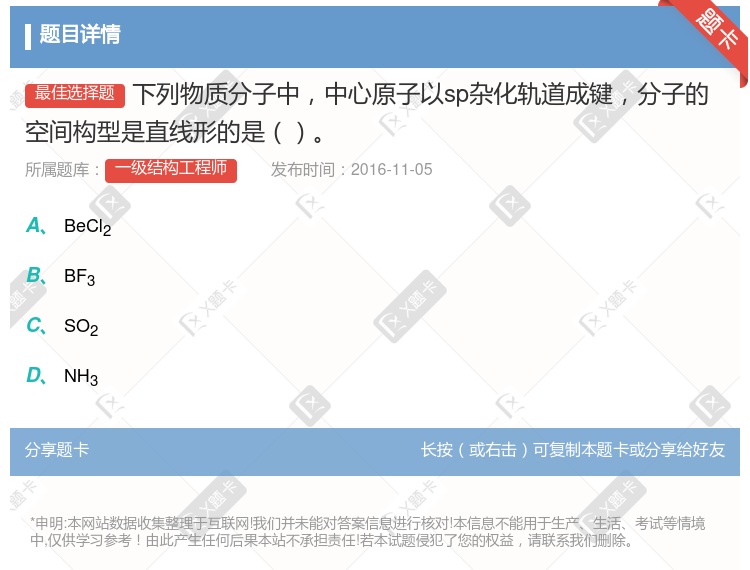
 型的共价化合物,其中心原子均采用sp
型的共价化合物,其中心原子均采用sp 杂化轨道成键 在AB
杂化轨道成键 在AB 型的共价化合物中,中心原子均采用sp杂化轨道成键 凡是中心原子采用sp
型的共价化合物中,中心原子均采用sp杂化轨道成键 凡是中心原子采用sp 杂化轨道成键后形成的分子,其空间构型都是正四面体 sp
杂化轨道成键后形成的分子,其空间构型都是正四面体 sp 杂化可分等性sp
杂化可分等性sp 杂化和不等性sp
杂化和不等性sp 杂化
杂化
 SO
SO BeCl
BeCl NH
NH