你可能感兴趣的试题
生铁片中的碳是原电池的负极,发生还原反应 雨水酸性较强,生铁片始终发生析氢腐蚀 墨水液面回升时,正极反应式为:O2+2H2O+4e-===4OH- U.型管中溶液pH逐渐减小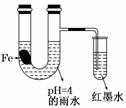
生铁块中的碳是原电池的正极 红墨水柱两边的液面变为左低右高 两试管中负极电极反应相同 a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
开始时发生的是析氢腐蚀
—段时间后发生的是吸氧腐蚀
两种腐蚀负极的电极反应均为:Fe-2e-=Fe2+
析氢腐蚀的总反应为:2Fe+O2+2H2O=2Fe(OH)2
生铁块中的碳是原电池的正极
红墨水柱两边的液面变为左低右高
两试管中负极电极反应相同
a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
生铁片中的碳是原电池的负极,发生还原反应 雨水酸性较强,生铁片始终发生析氢腐蚀 墨水液面回升时,正极反应式为:O2+2H2O+4e-===4OH- U.型管中溶液pH逐渐减小
生铁块中的主要成分是铁,也含有少量的碳 红墨水柱两边的液面变为左低右高 两试管中铁均被锈蚀 a试管中发生的反应是:2C+2Fe+3O2=2FeCO3 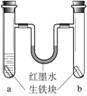
a中发生了吸氧腐蚀,b中发生了析氢腐蚀 两试管中负极反应均是:Fe – 2e-= Fe2+ 生铁块中碳作原电池正极 红墨水在一段时间后,两边液面变为左低右高
生铁块中的碳是原电池的正极 a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀 两试管中相同的电极反应式是:Fe-2e-= Fe2+ 红墨水柱两边的液面变为左低右高
生铁片中所含的碳能增强铁的抗腐蚀性 雨水酸性较强,生铁片开始发生析氢腐蚀 导管内墨水液面回升时,正极反应式:O2+2H2O+4e—=4OH- 随着反应的进行,U.型管中雨水的酸性逐渐减弱
生铁片中的碳是原电池的负极,发生还原反应 雨水酸性较强,生铁片始终发生析氢腐蚀 墨水液面回升时,正极反应式为O2+2H2O+4e-=4OH- U.形管中溶液pH逐渐减小
实验开始时可能有气体产生
一段时间后试管内有气体被反应
此实验能说明铁生锈的必要条件是水和氧气
U型管中液体的作用是显示出左右两端气压的变化
开始时发生的是析氢腐蚀 一段时间后发生的是吸氧腐蚀 两种腐蚀负极的电极反应均为:Fe - 2e-== Fe2+ 析氢腐蚀的总反应为:2Fe + O2 + 2H2O == 2Fe(OH)2 
生铁块中的碳是原电池的正极 两试管中相同的电极反应式是:Fe-2e-= Fe2+ 红墨水柱两边的液面变为左低右高 a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
开始时发生的是析氢腐蚀 一段时间后发生的是吸氧腐蚀 两种腐蚀负极的电极反应均为:Fe-2e—=Fe2+ 析氢腐蚀的总反应为:2Fe+O2+2H2O=2Fe(OH)2
开始时发生的是析氢腐蚀 一段时间后发生的是吸氧腐蚀 两种腐蚀负极的电极反应均为:Fe-2e—=Fe2+ 析氢腐蚀的总反应为:2Fe+O2+2H2O=2Fe(OH)2 
两种腐蚀负极的电极反应式均为Fe-2e-=Fe2+ 开始时发生的是析氢腐蚀 一段时间后发生的是吸氧腐蚀 消去反应的总反应式为2Fe+O2+2H2O=2Fe(OH)2





