
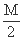 + 3N mol[
+ 3N mol[ 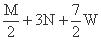 mol
mol 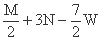 mol
mol
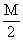 + 3N mol
+ 3N mol  mol
mol 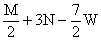 mol
mol
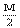 +3N
+3N 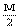 +3N+
+3N+ 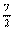 W
W 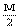 +3N-
+3N- 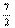 W
W
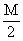 + 3N mol
+ 3N mol 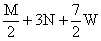 mol
mol  mol
mol
 2 NH3 ΔH=-92 kJ/mol a曲线是加入催化剂时的能量变化曲线 加入催化剂,该化学反应的反应热将发生改变 在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1
2 NH3 ΔH=-92 kJ/mol a曲线是加入催化剂时的能量变化曲线 加入催化剂,该化学反应的反应热将发生改变 在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1