你可能感兴趣的试题
在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量 基态Fe原子的外围电子排布图为: 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 根据原子核外电子排布的特点,Cu在周期表中属于s区元素
电子不停地做高速运动 电子在核外是分层排布的 每个电子层作为最外层时,最多可容纳8个电子 离原子核近的电子能量低,离原子核远的电子能量高
电子离核越近,能量越高 原子核外电子的运动没有规律 在多电子原子中,核外电子分层排布 电子一般尽可能排布在能量高的电子层中
原子由原子核和核外电子组成 原子由原子核和核外电子组成,原子核带正电,核外电子带负电 原子由原子核和核外电子组成,原子核体积小而紧密,核外电子运动空间大 原子由原子核和核外电子组成,原子核体积小而紧密,集中了整个原子的能量,带正电,核外电子运动空间大,质量很轻,带负电 原子由原子核和核外电子组成,原子核体积小而紧密,集中了整个原子的能量,带正电,核外电子运动空间大,质量很轻,带负电,一个原子的正负电荷数相等,原子呈中性
在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量 基态Fe原子的外围电子排布图为:  因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 根据原子核外电子排布的特点,Cu在周期表中属于s区元素
因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 根据原子核外电子排布的特点,Cu在周期表中属于s区元素
正确,符合核外电子排布规律 错误,违背了“能量最低原理” 错误,违背了“泡利原理” 错误,违背了“洪特规则”
原子由原子核和核外电子组成 原子由原子核和核外电子组成,原子核带正电,核外电子带负电 原子由原子核和核外电子组成,原子核体积小而紧密,核外电子运动空间大 原子由原子核和核外电子组成,原子核体积小而紧密,集中了整个原子的能量,带正电,核外电子运动空间大,质量很轻,带负电 原子由原子核和核外电子组成,原子核体积小而紧密,集中了整个原子的能量,带正电,核外电子运动空间大,质量很轻,带负电,一个原子的正负电荷数相等,原子呈中性
1s22s22p63s23p2→1s22s22p63s23p1 1s22s22p63s23p3→1s22s22p63s23p2 1s22s22p63s23p4→1s22s22p63s23p3 1s22s22p63s23p63d104s24p2→1s22s22p63s23p63d104s24p1
在基态多电子原子中,p 轨道电子能量一定高于 s 轨道电子能量 核外电子排布由 1s22s22p63s1 →1s22s22p6 的变化需要吸收能量 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 根据原子核外电子排布的特点,Cu 在周期表中属于 s 区元素
元素性质的周期性变化是指原子半径、元素的主要化合价及原子核外电子排布的周期性变化 元素性质的周期性变化决定于元素原子核外电子排布的周期性变化 从Li—→F,Na—→Cl,元素的最高化合价均呈现从+1价—→+7价的变化 电子层数相同的原子核外电子排布,其最外层电子数均从1个到8个呈现周 期性变化
电子从较高能量的激发态跃迁到较低能量的基态时,将释放能量 我们看到的灯光是原子核外电子发生跃迁吸收能量的结果 电子发生跃迁时吸收或释放能量不同,光谱不同 利用原子光谱的特征谱线可以鉴定元素
在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量 核外电子排布由1s22s22p63s1 →1s22s22p6 的变化需要吸收能量 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 根据原子核外电子排布的特点,Cu在周期表中属于s区元素
在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量 基态Fe原子的外围电子排布图为 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 根据原子核外电子排布的特点,Cu在元素周期表中位于s区
因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 根据原子核外电子排布的特点,Cu在元素周期表中位于s区
原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质相似 Fe3+的最外层电子排布式为3s23p63d5 基态铜原子的价电子排布图: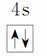
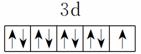 基态碳原子的价电子排布图:
基态碳原子的价电子排布图: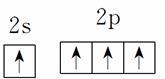
在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量 基态Fe原子的外围电子排布图为:  因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 根据原子核外电子排布的特点,Cu在周期表中属于s区元素
因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 根据原子核外电子排布的特点,Cu在周期表中属于s区元素
能量最低原 暴力不相容原理 洪特规则 以上三者都应遵循
原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质相似 Fe3+的最外层电子排布式为3s23p63d5 基态铜原子的价电子排布图: 基态碳原子的价电子排布图:
基态碳原子的价电子排布图:

 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 根据原子核外电子排布的特点,Cu在周期表中属于s区元素
因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 根据原子核外电子排布的特点,Cu在周期表中属于s区元素
 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 根据原子核外电子排布的特点,Cu在元素周期表中位于s区
因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 根据原子核外电子排布的特点,Cu在元素周期表中位于s区

 基态碳原子的价电子排布图:
基态碳原子的价电子排布图:
 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 根据原子核外电子排布的特点,Cu在周期表中属于s区元素
因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 根据原子核外电子排布的特点,Cu在周期表中属于s区元素
 基态碳原子的价电子排布图:
基态碳原子的价电子排布图: