你可能感兴趣的试题
右图可表示由CO生成CO2的反应过程和能量关系
CO的燃烧热为283kJ/mol
2 Na2O2(s)+2 CO2(s)=2 Na2CO3(s)+O2(g) △H.>﹣452kJ/mol
CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数为2NA
CO的标准燃烧热为283 kJ 下图可表示由CO生成CO2的反应过程和能量关系 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-532 kJ·mol-1 CO(g)与Na2O2(s)反应放出549 kJ热量时,电子转移数为6.02×1023
172.51 kJ/mol -283.01 kJ/mol 283.01 kJ/mol 504.00 kJ/mol
CO的燃烧热为566 kJ/mol 右图可表示由CO生成CO2的反应过程和能量关系 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH.>-452 kJ/mol CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移的物 质的量为为2 mol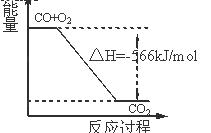
CO的燃烧热为283 kJ 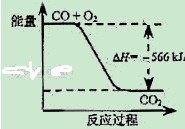 如图可表示由CO生成CO2的反应过程和能量关系 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>﹣452 kJ/mol CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
如图可表示由CO生成CO2的反应过程和能量关系 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>﹣452 kJ/mol CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
+172.51 kJ/mol +283.01 kJ/mol -283.01 kJ/mol -504.00 kJ/mol
需要加热才能发生的反应一定是吸热反应 已知NaOH(aq) +HCI(aq) =NaCI(aq)+H2O(1) △H=-57.3 kJ·mol-1, 则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出57.3 kJ的热量 CO(g)的燃烧热是283.0 kJ·mol-1,则表示CO(g)的燃烧热的热化学方程式为 2CO(g)+O2(g)=2CO2(g) △H=-283.0 kJ·mol-1 已知2C(s) +2O2(g)=2CO2(g) △H=a,2C(s) +O2(g)=2CO(g) △H=b,则b>a
CO(g)的燃烧热:ΔH=-283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的 ΔH=+566.0kJ/mol 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H.=-57.3 kJ·mol-1, 则含40.0g NaOH的稀溶液与稀醋酸完全中和,放出57.3kJ的热量 己知2C(s)+2O2(g)=2CO2(g) △H = a;2C(s)+O2(g)=2CO(g);△H = b,则a>b 已知C (石墨,s)=C (金刚石,s) △H.>0,则石墨比金刚石稳定
12 gC.所具有的能量一定高于28 g CO所具有的能量 56 g CO和32 g O2所具有的总能量大于88 g CO2所具有的能量 12 gC.和32 g O2所具有的总能量大于44 g CO2所具有的总能量 将一定质量的C.燃烧,生成CO2比生成CO时放出的热量多
CO的燃烧热为283 kJ 由CO生成CO2的反应过程是吸热反应 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH.>-452kJ/mol CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
+172.51 kJ/mol -283.01 kJ/mol +283.01 kJ/mol +504.00 kJ/mol
CO的燃烧热为283 kJ 右图可表示由CO生成CO2的反应过程和能量关系 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH.< --452 kJ/mol CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2×6.02×1023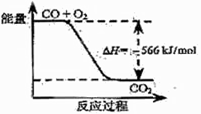
CO的燃烧热为283 kJ 右图可表示由CO生成CO2的反应过程和能量关系 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>—452 kJ/mol CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
CO的燃烧热为283kJ 右图可表示由CO生成CO2的反应过程和能量关系 2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g) △H=—452kJ/mol CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数为6.02×1023
CO的燃烧热为 283 kJ 反应①正反应活化能与逆反应活化能之差为+566 kJ/mol 反应 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol CO(g)与 Na2O2(s)反应放出 509 kJ 热量时,电子转移数为 6.02×1023
需要加热才能发生的反应一定是吸热反应 已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀 溶液与稀醋酸完全中和,放出57.3 kJ的热量 CO(g)的燃烧热是283.0 kJ·mol-1,则表示CO(g)的燃烧热的热化学方程式为2CO(g)+O2(g)==2CO2(g) ΔH=-283.0 kJ·mol-1 已知2C(s)+2O2(g)===2CO2(g) ΔH=a,2C(s)+O2(g)===2CO(g) ΔH=b,则b>a


 如图可表示由CO生成CO2的反应过程和能量关系 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>﹣452 kJ/mol CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
如图可表示由CO生成CO2的反应过程和能量关系 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>﹣452 kJ/mol CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
