你可能感兴趣的试题
产物所具有的总能量高于反应物所具有的总能量 反应物所具有的总能量高于产物所具有的总能量 断开1 mol H—H键和1 mol Cl—Cl键所吸收的总能量大于形成1mol H—Cl键所放出的能量 该反应中,化学能只转变为热能
Na与H2O的反应是熵增的放热反应,该反应能自发进行 某吸热反应能自发进行,因此该反应一定是熵增反应 通常情况下,一个放热且熵增的反应也有可能非自发进行 反应NH3(g)+HCl(g)====NH4Cl(s)在室温下可自发进行,则该反应的ΔH. <0
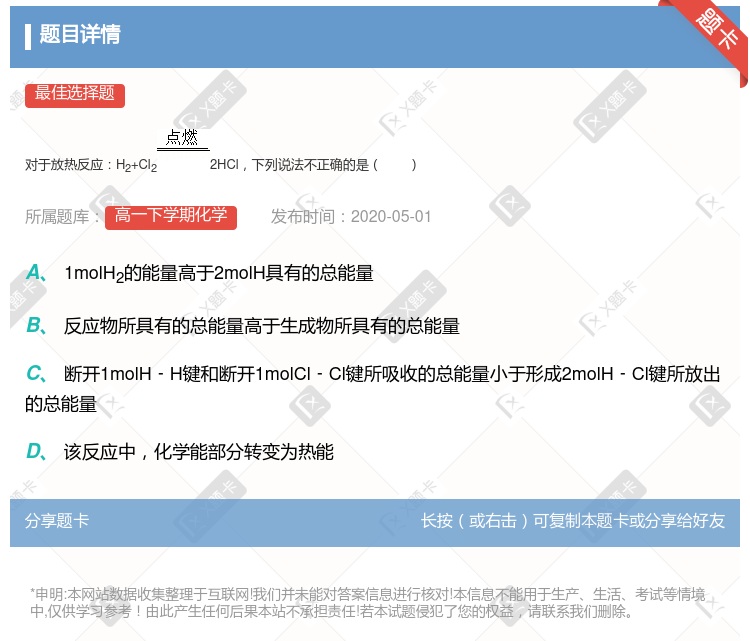
生成物所具有的总能量高于反应物所具有的总能量 反应物所具有的总能量高于生成物所具有的总能量 断开1molH-H.键和1molCl-Cl键所吸收的总能量大于形成2molH-Cl键所放出的 能量 该反应中,化学能只转变为热能
该反应涉及到离子键和共价键的断裂与形成 该反应中,化学能只转变为热能 断开1molH﹣H.键和1molCl﹣Cl键所吸收的总能量,小于形成1molH﹣Cl键所放出的能量 反应物所具有的总能量高于产物所具有的总能量
化学反应中的能量变化,通常表现为热量的变化 反应物的总能量高于生成物的总能量时发生放热反应 Ba(OH)2·8H2O与NH4Cl的反应是吸热反应 凡是放热反应不需要加热就能发生
产物所具有的总能量高于反应物所具有的总能量 反应物所具有的总能量高于产物所具有的总能量 断开1mol H—H键和1mol Cl—Cl键所吸收的总能量小于形成1mol H—Cl键所放出的能量 该反应中,化学能只有转变为热能
产物所具有的总能量高于反应物所具有的总能量 反应物所具有的总能量高于产物所具有的总能量 断开1 molH.-H.键和1 mol Cl-Cl键所吸收的总能量大于形成1molH.-Cl键所放出的能量 该反应中,化学能只转变为热能
强酸与强碱反应都是放热反应 氧化还原反应一定都是放热反应 放热反应的反应速率总是大于吸热反应的反应速率 同温同压下,反应H2(g)+Cl2(g)  2HCl(g)在光照和点燃条件下的
2HCl(g)在光照和点燃条件下的 不同
不同
化学反应中的能量变化,通常表现为热量的变化 放热反应发生时不必加热 木炭在氧气中的燃烧是吸热反应 Ba(OH)2・8H2O与NH4Cl的反应是放热反应
Na与H2O的反应是熵增的放热反应,该反应能自发进行 某吸热反应能自发进行,因此该反应是熵增反应 2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH.>0 反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的ΔH.<0
产物所具有的总能量高于反应物所具有的总能量 反应物所具有的总能量高于产物所具有的总能量 断开1mol H-H键和1mol Cl-Cl键所吸收的总能量大于形成1mol H-Cl键所放出的能量 该反应中,化学能只转变为了热能
强酸与强碱反应都是放热反应 氧化还原反应一定都是放热反应 放热反应的反应速率总是大于吸热反应的反应速率 同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的 不同
不同
Ba(OH)2·8H2O与NH4Cl反应是放热反应 铝热反应是放热反应 镁与盐酸反应是吸热反应 2个H.变成氢分子(H.-H.)需吸收能量
该反应为吸热反应 该反应为放热反应 断裂H—H键吸收能量 生成H—O键放出能量
生成物总能量不一定低于反应物总能量 放热反应的反应速率总是大于吸热反应的反应速率 应用盖斯定律,可计算某些难以直接测量的反应焓变 同温同压下,H2(g)+ Cl2(g) = 2HCl(g)在光照和点燃条件下的△H.相同
需要加热才能发生的反应一定是吸热反应 中和反应都是放热反应 放热反应的反应速率总是大于吸热反应的反应速率 同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的 不同
不同
反应物所具有的总能量高于产物所具有的总能量 1molCl2所具有的能量高于2molHCl所具有的总能量 断开1molH-H键和1molCL-CL键吸收的总能量小于1molH-Cl形成键所放出的能量 该反应中,化学能只有转变为热能
产物所具有的总能量高于反应物所具有的总能量 反应物所具有的总能量高于产物所具有的总能量 断开1mol H—H键和1mol Cl—Cl键所吸收的总能量大于形成2mol H—Cl键所放出的能量 该反应中形成原电池时,氢气在正极反应
ΔE.1是该反应的活化能 ΔE.2是2 mol H—Cl键的总键能 加入催化剂可以改变反应的焓变 该反应是一个放热反应
产物所具有的总能量高于反应物所具有的总能量 反应物所具有的总能量高于产物所具有的总能量 断开1 molH.—H.键和1 mol Cl—Cl键所吸收的总能量大于形成1mol H.—Cl键所放出的能量 该反应中,化学能只转变为热能
 2HCl(g)在光照和点燃条件下的
2HCl(g)在光照和点燃条件下的 不同
不同
 不同
不同
 不同
不同