你可能感兴趣的试题
K >Na >Li Na+>Mg2+>Al3+ Mg2+> Al3+>F— Cl—>F—>F
Be<Na<Mg Be<Mg<Na B<C<N I<Br<K
酸性强弱: HI > HBr > HCl > HF 原子半径大小: Na > S >O. 碱性强弱: KOH > NaOH > LiOH 还原性强弱:F.- > Cl- >I.-
酸性强弱:HIO4>HBrO4>HClO4 原子半径大小:Mg>P>N 碱性强弱:KOH>NaOH>LiOH 金属性强弱:Na>Mg>Al
K>Na>Li Na+>Mg2+>Al3+ Mg2+>Na+>F- Cl->F->F
金属性强弱:Na >Mg> Al 原子半径大小:Na> S >O 碱性强弱:KOH > NaOH > LiOH 酸性强弱:HIO4 >HBrO4> HClO4
酸性强弱:HIO4 >HBrO4>HClO4 原子半径大小:Na >S>O 碱性强弱:KOH>NaOH>LiOH 金属性强弱:Na >Mg>Al
酸性强弱:HIO4>HBrO4>HClO4 原子半径大小:Na>S>O 碱性强弱:KOH>NaOH>LiOH 金属性强弱:Na>Mg>Al
酸性强弱:HIO4>HBrO4>HClO4 原子半径大小:Na>S>O 碱性强弱:KOH>NaOH>LiOH 金属性强弱: Na>Mg>Al
ZY、ZW、W2X的水溶液都显酸性 原子半径大小:W.>R.>X., 简单离子半径大小:R >W >X W.的氢化物与R.的氢化物水溶液的酸性比较,前者强于后者,可证明非金属性:R>W Z.与X.,Z.与R.两种元素形成的化合物中均可能存在共价键 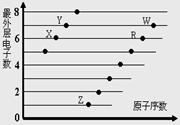
电子层结构相同的粒子随核电荷的递增半径逐渐增大 CsCl、NaBr、CaF2、LiI四种化合物中LiI的阴阳离子半径之比值最大 S2-半径小于硫原子半径 无法比较K+、Al3+ 、O2- 、Cl-的半径大小
酸性强弱: HI > HBr > HCl > HF 原子半径大小: Na > S > O
碱性强弱: KOH > NaOH > LiOH 还原性强弱: F- > Cl- > I-
酸性强弱: HI > HBr > HCl > HF 原子半径大小: Na > S >O. 碱性强弱: KOH > NaOH > LiOH 还原性强弱: F- > Cl- > I-
酸性强弱: HI>HBr>HCl>HF 原子半径大小: Na>S>O 碱性强弱: KOH>NaOH>LiOH 还原性强弱:F.->Cl->I-
原子半径与质量大小成正比 原子半径决定质量大小 钾钠的排列是化学元素周期表中的特例 原子质量决定半径大小
K >Na >Li Na+>Mg2+>Al3+ Mg2+>Na+>F-- Cl-->F-->F
酸性强弱: HI<HBr<HCl<HF 原子半径大小: Na > S > O
碱性强弱: KOH<NaOH<LiOH 还原性强弱: F- > Cl- > I-
金属性Na > Mg > Al 原子半径大小: S > Cl >F. 稳定性 PH3 > H2S > HF 碱性强弱:KOH > NaOH > LiOH
K >Na >Li Na+>Mg2+>Al3+ Cl—>F—>F Mg2+>Na+>F—

