你可能感兴趣的试题
向FeCl3和KSCN混合溶液中加入少量KCl固体,溶液血红色变浅 向5mL0.1mol/LK2Cr2O7溶液中加入少量NaOH固体,溶液由橙色变为黄色 等体积等浓度Na2S2O3和H2SO4混合,温度升高出现浑浊和生成气体速度加快 酸性KMnO4溶液中滴加H2C2O4,H2C2O4浓度越大褪色和生成气体速度越快
V.(NaOH)=0时,c(H+)=1×10-2 mol•L-1 V.(NaOH)<10 mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) V.(NaOH)=10 mL时,c(H+)=1×10-7 mol/L V.(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4-)
V.(NaOH)=0时,c(H+)=0.01 mol•L-1 V.(NaOH)<10 mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) V.(NaOH)=10 mL时,c(H+)=1×10-7 mol/L V.(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4-)
a点pH>2 b点表示的溶液中c(C2O42-)>c(H2C2O4) c点时加入NaOH溶液的体积为20mL d点存在c(Na+)+c(H+)=c(OH-)+2c(C2O42-)+c(HC2O4-)
PH=2.5的溶液中:c(H2C2O4)+c(C2O42-)>c(HC2O4-) c(Na+)=0.100mol•L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-) c(HC2O4-)=c(C2O42-)的溶液中:c(Na+)>0.100mol•L-1+c(HC2O4-) PH=7的溶液中:c(Na+)>2c(C2O42-)
C(K+)+C(H+)=C(HC2O4¯)+C(OH¯)+ C(C2O42-) C(K+)=C(HC2O4¯)+2C(C2O42-) C(K+)= C(H2C2O4)+C(HC2O4¯)+ C(C2O42-) V.总≧20mL
V.(NaOH)= 0时,由水电离出的c(H+)= 1 × 10-2 mol/L. V.(NaOH)<10 mL时,不可能存在c(Na+)= 2c(C2O42-)+ c(HC2O4-) V.(NaOH)=10 mL时,由水电离出的c(H+)= 1 × 10-7mol/L. V.(NaOH)>10 mL时,c(Na+)> c(C2O42-)>c(HC2O4-)
V(NaOH) = 0时,c(H+)=1×10—2mol/L V(NaOH) <10mL时,一定存在c(Na+)=c(C2O42-)+c(HC2O4- ) V(NaOH) = 10 mL时,c(H+) = 1×10—7 mol/L V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4- )
V.(NaOH)=0时,c(H+)=1×10-2 mol•L-1 V.(NaOH)<10 mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) V.(NaOH)=10 mL时,c(H+)=1×10-7 mol/L V.(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)
V.(NaOH)= 0时,由水电离出的c(H+)= 1 × 10-2 mol/L. V.(NaOH)<10 mL时,不可能存在c(Na+)= 2c(C2O42-)+ c(HC2O4-) V.(NaOH)=10 mL时,由水电离出的c(H+)= 1 × 10-7mol/L. V.(NaOH)>10 mL时,c(Na+)> c(C2O42-)>c(HC2O4-)
K.a1=10-1.2 pH=2.7时溶液中: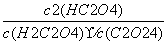 =1000 将相同物质的量的KHC2O4和K2C2O4固体完全溶于水便是配得pH为4.2的混合液 向pH=1.2的溶液中加KOH溶液,将pH增大至4.2的过程中水的电离程度一直增大
=1000 将相同物质的量的KHC2O4和K2C2O4固体完全溶于水便是配得pH为4.2的混合液 向pH=1.2的溶液中加KOH溶液,将pH增大至4.2的过程中水的电离程度一直增大
C (FeSO4)=C(H2C2O4) C (FeSO4)=2C(H2C2O4) C (H2C2O4)=2C(FeSO4) C (FeSO4)=4C(H2C2O4)
若将溶液不断加水稀释,则水的电离程度增大 溶液中各离子浓度大小关系:c(Na+)> c(C2O42-)> c(OH-)> c(H+)> c(HC2O4-) 若用pH计测得溶液的pH=9,则H2C2O4的第二级电离平衡常数Ka2=10-5 向溶液中加入等体积CaCl2溶液,当加入的CaCl2溶液浓度大于2.4×10-8 mol·L-1 时即能产生沉淀
V(NaOH) = 0时,c(H+) = 1×10-2 mol·L.-1 V(NaOH)<10 mL时,不可能存在c(Na+) = 2c(C2O42 -)+c(HC2O4- ) V(NaOH) = 10 mL时,c(H+) = 1×10-7 mol·L.-1 V(NaOH)>10 mL时,c(Na+)>c(C2O42 -)>c(HC2O4- )

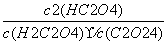 =1000 将相同物质的量的KHC2O4和K2C2O4固体完全溶于水便是配得pH为4.2的混合液 向pH=1.2的溶液中加KOH溶液,将pH增大至4.2的过程中水的电离程度一直增大
=1000 将相同物质的量的KHC2O4和K2C2O4固体完全溶于水便是配得pH为4.2的混合液 向pH=1.2的溶液中加KOH溶液,将pH增大至4.2的过程中水的电离程度一直增大