你可能感兴趣的试题
v(N2)=v(NO) 反应①的焓变ΔH保持恒定 体系的密度不再发生变化 混合气体的平均相对分子质量不再发生变化
Q1>Q3>Q2 =78.8kJ 三个容器中反应的平衡常数均为K=2 甲中反应达到平衡时,若升高温度,则SO2的转化率将大于50% 若乙容器中的反应经tmin达到平衡,则0~tmin内,v(O2)=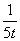 mol/(L.·min)
mol/(L.·min)
H2(g)+Cl2(g)=2HCl(g);△H=-a 1/2H2(g)+1/2Cl2(g)=HCl(g);△H=-b C(s)+1/2O2(g)=CO (g);△H=-a (s)+O2(g)=CO2 (g);△H=-b C. 2H2(g)+O2(g)=2H2O(l);△H=-a 2H2(g)+O2(g)=2H2O(g);△H=-b S(g)+O2(g)=SO2 (g);△H=-a S(s)+O2(g)=SO2 (g);△H=-b
容器①中反应达平衡时,CO的转化率为80% 容器①中CO的转化率等于容器②中CO2的转化率 平衡时,两容器中CO2的浓度相等 容器①中反应速率:v(CO)= v(H2O)
由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则向含0.1 mol HCl的盐酸中加入4.0 gNaOH固体,放出热量等于5.73 kJ 等量H2在O2中完全燃烧生成H2O(g)与生成H2O(l),放出的能量相同 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 氢气的燃烧热为285.8 kJ·mol-1,则水分解的热化学方程式为:2H2O(l)=2H2(g) + O2(g) ΔH=+ 571.6 kJ·mol-1
2H2(g)+O2(g)==2H2O(g) △H.1 2H2(g)+O2(g)==2H2O(l) △H.2 S(g)+O2(g)==SO2(g) △H.1 S(s)+O2(g)==SO2(g) △H.2 C.(s)+  O2(g)==CO(g) △H.1C.(s)+ O2(g)==CO2(g) △H.2 H2(g)+ Cl2(g)==2HCl(g) △H.1
O2(g)==CO(g) △H.1C.(s)+ O2(g)==CO2(g) △H.2 H2(g)+ Cl2(g)==2HCl(g) △H.1  H2(g)+
H2(g)+  Cl2(g)==HCl(g) △H.2
Cl2(g)==HCl(g) △H.2
S(s) + O2 (g) =SO2 (g); △H1 S(g) + O2 (g) =SO2 (g);△H2 2H2(g) + O2 (g)= 2H2O(g);△H1 2H2 (g) + O2 (g) = 2H2O(l);△H2 CO(g) + 1/2 O2(g) = CO2(g);△H1 2CO(g) + O2(g) = 2CO2(g);△H2 H2 (g) +Cl2(g)=2HCl(g);△H1 1/2 H2(g) + 1/2 Cl2(g) = HCl(g);△H2
2H2(g) + O2(g)= 2H2O(g) △H1 ; 2H2(g) + O2(g) = 2H2O(l) △H2 S(g) + O2(g) =SO2(g) △H1 ; S(s) + O2(g) = SO2(g) △H2 CO(g) + 1/2 O2(g) = CO2(g) △H1 ;2CO(g) + O2(g) = 2CO2(g) △H2 C.(s)+H2O(g)=CO(g)+H2(g) △H1 ;CaO(s)+H2O(l)===Ca(OH)2(s) △H2
2H2(g)+O2(g)=2H2O(l) NO(g)+(1/2)O2(g)=NO2(g) C(金刚石)=C(石墨) H2(g)+(1/2)O2(g)=H2O(l)
等质量的钠分别发生反应①和②,产物的阴阳离子个数比相等 ①和②生成等物质的量的产物,转移电子数不同 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 25℃、101kPa 下,Na2O2(s)+2 Na(s)= 2Na2O(s) △H=-317kJ/mol
Ag2O(g)→2Ag(s)+(1/2)O2(g) Fe2O3(s)+(3/2)C(s)→2Fe+(3/2)CO2(g) N2O4(g)→2NO2(g) 6C(s)+6H2O(l)→C6H12O6(s)
容器①中反应达平衡时,CO的转化率为80% 容器①中CO的转化率等于容器②中CO2的转化率 平衡时,两容器中CO2的浓度相等 容器①时CO的反应速率等于H2O的反应速率

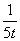 mol/(L.·min)
mol/(L.·min)
 O2(g)==CO(g) △H.1C.(s)+ O2(g)==CO2(g) △H.2 H2(g)+ Cl2(g)==2HCl(g) △H.1
O2(g)==CO(g) △H.1C.(s)+ O2(g)==CO2(g) △H.2 H2(g)+ Cl2(g)==2HCl(g) △H.1  H2(g)+
H2(g)+  Cl2(g)==HCl(g) △H.2
Cl2(g)==HCl(g) △H.2