
 2C(g),可以判断达到化学平衡状态的是A. 体系压强不变 单位时间消耗n molA,同时生成2n molC A.的转化率不变 容器内气体密度不变
2C(g),可以判断达到化学平衡状态的是A. 体系压强不变 单位时间消耗n molA,同时生成2n molC A.的转化率不变 容器内气体密度不变
 2C(g)。该反应进行到一定限度后达到化学平衡的标志是 A.单位时间内生成a mol物质A.,同时生成3a mol物质 B.容器内气体的密度不再随时间而改变 物质C.的生成速率和分解速率相等 物质A.B.C.的分子数之比为1:3:2
2C(g)。该反应进行到一定限度后达到化学平衡的标志是 A.单位时间内生成a mol物质A.,同时生成3a mol物质 B.容器内气体的密度不再随时间而改变 物质C.的生成速率和分解速率相等 物质A.B.C.的分子数之比为1:3:2
 2C(g) ΔH<0。2min后,反应达到平衡,生成 为1.6mol。则下列分析正确的是 A.若反应开始时容器体积为2L,则Vc=0.4mol•L-1•min-1 B.若在恒压绝热条件下反应,平衡后nc<1.6mol C.若2min后,向容器中再投入等物质的量A.C.,B.的转化率不变 若该反应在恒温恒容下进行,放出热量将增加
2C(g) ΔH<0。2min后,反应达到平衡,生成 为1.6mol。则下列分析正确的是 A.若反应开始时容器体积为2L,则Vc=0.4mol•L-1•min-1 B.若在恒压绝热条件下反应,平衡后nc<1.6mol C.若2min后,向容器中再投入等物质的量A.C.,B.的转化率不变 若该反应在恒温恒容下进行,放出热量将增加
 2HBr(g) 恒温、恒容下,反应体系中气体的颜色保持不变 2NO2(g)
2HBr(g) 恒温、恒容下,反应体系中气体的颜色保持不变 2NO2(g)  N2O4(g) 恒温、恒容下,反应体系中气体的压强保持不变 CaCO3(s)
N2O4(g) 恒温、恒容下,反应体系中气体的压强保持不变 CaCO3(s)  CO2(g)+CaO(s) 恒温、恒容下,反应体系中气体的密度保持不变 3H2(g)+N2(g)
CO2(g)+CaO(s) 恒温、恒容下,反应体系中气体的密度保持不变 3H2(g)+N2(g)  2NH3(g) 反应体系中H2与N2的物质的量之比保持3∶1
2NH3(g) 反应体系中H2与N2的物质的量之比保持3∶1
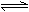 2C(g)容器中达到平衡的标志是A.C.生成的速率与 生成的速率相等 B. 单位时间内生成n molA.,同时生成3n molB. 容器内总压强不随时间而改变 A.B.C.分子数之比为1 :3 :2
2C(g)容器中达到平衡的标志是A.C.生成的速率与 生成的速率相等 B. 单位时间内生成n molA.,同时生成3n molB. 容器内总压强不随时间而改变 A.B.C.分子数之比为1 :3 :2
 2HBr(g) 恒温、恒容下,反应体系中气体的颜色保持不变 2NO2(g)
2HBr(g) 恒温、恒容下,反应体系中气体的颜色保持不变 2NO2(g) N2O4(g) 恒温、恒容下,反应体系中气体的压强保持不变 CaCO3(s)
N2O4(g) 恒温、恒容下,反应体系中气体的压强保持不变 CaCO3(s)
 CO2(g)+CaO(s) 恒温、恒容下,反应体系中气体的密度保持不变 3H2(g)+N2(g)
CO2(g)+CaO(s) 恒温、恒容下,反应体系中气体的密度保持不变 3H2(g)+N2(g) 2NH3(g) 反应体系中H2与N2的物质的量之比保持3∶1
2NH3(g) 反应体系中H2与N2的物质的量之比保持3∶1
 2C(g) ΔH<0。2min后,反应达到平衡,生成 为1.6mol。则下列分析正确的是 A.若反应开始时容器体积为2L,则v(C.)=0.4mol•L-1•min-1 B.若该反应在恒温恒容下进行,放出热量将增加 C.若2min后,向容器中再投入等物质的量A.C.,B.的转化率不变 若在恒压绝热条件下反应,平衡后n(C.)<1.6mol
2C(g) ΔH<0。2min后,反应达到平衡,生成 为1.6mol。则下列分析正确的是 A.若反应开始时容器体积为2L,则v(C.)=0.4mol•L-1•min-1 B.若该反应在恒温恒容下进行,放出热量将增加 C.若2min后,向容器中再投入等物质的量A.C.,B.的转化率不变 若在恒压绝热条件下反应,平衡后n(C.)<1.6mol
 2C(g);△H<0.有甲乙两个容积为0.5L的密闭容 器,向甲容器中加入1molA的和3molB在一定条件下达到平衡时放出热量为Q1 kJ;在 相同条件下,向乙容器中加入2molC.达到平衡时吸收热量为Q2kJ;已知Q2=3Q1.下列 叙述不正确的是 A.乙中C.的转化率为75% 反应达到平衡前,甲中始终有v正大于v逆,乙中始终有v正小于v逆 在该条件下,反应 2C(g)
2C(g);△H<0.有甲乙两个容积为0.5L的密闭容 器,向甲容器中加入1molA的和3molB在一定条件下达到平衡时放出热量为Q1 kJ;在 相同条件下,向乙容器中加入2molC.达到平衡时吸收热量为Q2kJ;已知Q2=3Q1.下列 叙述不正确的是 A.乙中C.的转化率为75% 反应达到平衡前,甲中始终有v正大于v逆,乙中始终有v正小于v逆 在该条件下,反应 2C(g) A(g)+3B(g)的平衡常数为27×1.54 乙中的热化学方程式为2C(g)
A(g)+3B(g)的平衡常数为27×1.54 乙中的热化学方程式为2C(g) A(g)+3B(g);△H=+Q2kJ/mol
A(g)+3B(g);△H=+Q2kJ/mol
 xC(g),达到化学平衡后, 的体积分数为a。假设该反应的条件分别和下列各选项的条件相同,下列判断不正确的是( ) A.若在恒温恒压下,当x=1时,按1.5 molA.1 molC.作为起始物质,达到平衡后,C.的体积分数仍为aB.若在恒温恒容下,当x=2时,将2molC作起始物质,达到平衡后,C.的体积分数仍为aC.若在恒温恒压下,当x=3时,1 molA.1molB.6molC.作起始物质,达到平衡后,C.的体积分数仍为a 若在恒温恒容下,按0.6molA.0.3molB.1.4molC.作起始物质,达到平衡后,C.的体积分数仍为a,则x为2或3
xC(g),达到化学平衡后, 的体积分数为a。假设该反应的条件分别和下列各选项的条件相同,下列判断不正确的是( ) A.若在恒温恒压下,当x=1时,按1.5 molA.1 molC.作为起始物质,达到平衡后,C.的体积分数仍为aB.若在恒温恒容下,当x=2时,将2molC作起始物质,达到平衡后,C.的体积分数仍为aC.若在恒温恒压下,当x=3时,1 molA.1molB.6molC.作起始物质,达到平衡后,C.的体积分数仍为a 若在恒温恒容下,按0.6molA.0.3molB.1.4molC.作起始物质,达到平衡后,C.的体积分数仍为a,则x为2或3
 2C(g)达到平衡状态的标志 A.A的消耗速率是C.的分解速率1/2倍 容器内混合气体的密度不随时间而变化 单位时间内生成nmolA,同时生成3nmolB A.B.C.的分子数之比为1:3:2
2C(g)达到平衡状态的标志 A.A的消耗速率是C.的分解速率1/2倍 容器内混合气体的密度不随时间而变化 单位时间内生成nmolA,同时生成3nmolB A.B.C.的分子数之比为1:3:2
 2C(g),可以判断达到化学平衡状态的是( ) A. 体系压强不变 单位时间消耗n molA,同时生成2nmolC A.的转化率不变 容器内气体密度不变
2C(g),可以判断达到化学平衡状态的是( ) A. 体系压强不变 单位时间消耗n molA,同时生成2nmolC A.的转化率不变 容器内气体密度不变
 MgO(s) + CO2(g) + SO2(g),横坐标代表 硫酸镁的质量,纵坐标可代表 CO 的转化率 图②表示其他条件一定时,反应A.(g)+3B(g)
MgO(s) + CO2(g) + SO2(g),横坐标代表 硫酸镁的质量,纵坐标可代表 CO 的转化率 图②表示其他条件一定时,反应A.(g)+3B(g) 2C(g)的反应速率随温度变化的图像, 正反应ΔH>0 图③对应的反应一定是非等体积反应加压后平衡移动的变化情况 恒压密闭容器中加入一定量A.B.,发生反应A.(g)+3B(g)
2C(g)的反应速率随温度变化的图像, 正反应ΔH>0 图③对应的反应一定是非等体积反应加压后平衡移动的变化情况 恒压密闭容器中加入一定量A.B.,发生反应A.(g)+3B(g) 2C(g),图④表示反应过 程中不断升高温度,产物C.物质的量变化规律,则正反应方向吸热-1
2C(g),图④表示反应过 程中不断升高温度,产物C.物质的量变化规律,则正反应方向吸热-1
 2C(g),5 min后各容器反应达平衡状态,其中甲容器中A.的物质的量为0.4 mol。 反应前各物质的物质的量/mol A. C. 甲 1 3 0 乙 0 0 2 丙 1.5 4.5 1 下列说法正确的是 ( ) A.乙中5 min内 的反应速率为0.16 mol·L-1·min-1 B.达到平衡时,丙中A.的浓度是甲中的2倍 C.丙中反应的平衡常数大于甲中反应的平衡常数 达到平衡时,甲乙两容器中C.的物质的量百分含量相等
2C(g),5 min后各容器反应达平衡状态,其中甲容器中A.的物质的量为0.4 mol。 反应前各物质的物质的量/mol A. C. 甲 1 3 0 乙 0 0 2 丙 1.5 4.5 1 下列说法正确的是 ( ) A.乙中5 min内 的反应速率为0.16 mol·L-1·min-1 B.达到平衡时,丙中A.的浓度是甲中的2倍 C.丙中反应的平衡常数大于甲中反应的平衡常数 达到平衡时,甲乙两容器中C.的物质的量百分含量相等
 2C(g);△H.<0。有甲乙两个容积为0.5L的密闭容器,向甲容器中加入1molA的和3molB在一定条件下达到平衡时放出热量为Q1kJ;在相同条件下,向乙容器中加入2molC达到平衡时吸收热量为Q2kJ;已知Q2=3Q1。下列叙述正确的是 A.乙中的热化学方程式为2C(g)
2C(g);△H.<0。有甲乙两个容积为0.5L的密闭容器,向甲容器中加入1molA的和3molB在一定条件下达到平衡时放出热量为Q1kJ;在相同条件下,向乙容器中加入2molC达到平衡时吸收热量为Q2kJ;已知Q2=3Q1。下列叙述正确的是 A.乙中的热化学方程式为2C(g) A.(g)+3B(g);△H.=+4Q2/3kJ/mol 反应达到平衡前,甲中始终有v正大于v逆,乙中始终有v正大于v逆 在该条件下,反应2C(g)
A.(g)+3B(g);△H.=+4Q2/3kJ/mol 反应达到平衡前,甲中始终有v正大于v逆,乙中始终有v正大于v逆 在该条件下,反应2C(g) A.(g)+3B(g)的平衡常数为9×1.52(mol/L)2 乙中C.的转化率为25℅
A.(g)+3B(g)的平衡常数为9×1.52(mol/L)2 乙中C.的转化率为25℅