
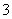 电解槽内发生反应的总化学方程式:KI+3H2O
电解槽内发生反应的总化学方程式:KI+3H2O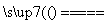 KIO3+3H2↑ 如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学反应不变
KIO3+3H2↑ 如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学反应不变 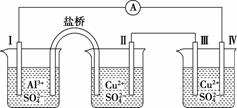
 KIO3+3H2↑ 如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变
KIO3+3H2↑ 如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变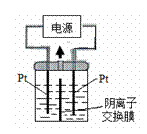
 KIO3+3H2↑ 如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变
KIO3+3H2↑ 如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变
 KIO3+3H2↑
KIO3+3H2↑ 
 KIO3+3H2↑
KIO3+3H2↑
 KIO3+3H2↑ 如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变
KIO3+3H2↑ 如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变 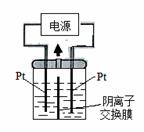
 KIO3+3H2↑ 如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学反应不变
KIO3+3H2↑ 如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学反应不变